题目内容
17.下列变化中,不破坏化学键的是( )| A. | HCl溶于水 | B. | 碘的升华 | C. | 水的电解 | D. | 金刚石熔化 |
分析 化学变化中及电离过程一定破坏化学键,原子晶体熔化也破坏化学键,非电解质的溶解、分子形态的变化中化学键不变,以此来解答.
解答 解:A.发生电离,H-Cl共价键的断裂,故A不选;
B.升华只破坏分子间作用力,化学键不变,故B选;
C.电解为化学变化,化学键断裂,故C不选;
D.金刚石熔化破坏共价键,故D不选;
故选B.
点评 本题考查化学键,为高频考点,把握化学键的形成及化学键判断的一般规律为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 天天向上口算本系列答案
天天向上口算本系列答案
相关题目
7.在同温同压下,下列各组热化学方程式中,△H2>△H1的是( )
| A. | S(s)+O2(g)═SO2(g)△H1;S(g)+O2(g)═SO2(g)△H2 | |
| B. | 2H2(g)+O2(g)═2H2O(g)△H1;2H2(g)+O2(g)═2H2O(l)△H2 | |
| C. | H2(g)+Cl2(g)═2HCl(g)△H1;$\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g)△H2 | |
| D. | CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H1;2CO(g)+O2(g)═2CO2(g)△H2 |
8.在容积一定的密闭容器中,反应2A?B(g)+C(g)达到平衡后,升高温度容器内气体的密度增大,则下列叙述正确的是( )
| A. | 正反应是吸热反应,且A是气态 | |
| B. | 正反应是放热反应,且A不是气态 | |
| C. | 其他条件不变,加入少量A,该平衡不移动 | |
| D. | 改变压强对该平衡的移动无影响 |
5.根据原子结构及元素周期律的知识,下列推断正确的是( )
| A. | 从HF、HCl、HBr、HI酸性递增的事实,推出F、Cl、Br、I的非金属递增的规律 | |
| B. | IA族与ⅦA族元素间可形成离子键也可形成共价键 | |
| C. | Cl-、S2-、Ca2+、K+半径逐渐减小 | |
| D. | 同周期金属元素的化合价越高,其原子失电子能力越强 |
12.化学与环境密切相关.下列有关说法错误的是( )
| A. | CO、NO能与人体的血红蛋白结合,使人中毒 | |
| B. | CaO能与SO2反应,可作工业废气的脱硫剂 | |
| C. | 光化学烟雾会引起呼吸道疾病 | |
| D. | CO2、NO2或SO2都会导致酸雨的形成 |
2.如图是部分短周期元素化合价与原子序数的关系图,下列说法不正确的是( )

| A. | 离子半径:X>Y>Z | |
| B. | 气态氢化物的稳定性:R>W | |
| C. | WX3和水反应形成的化合物是离子化合物 | |
| D. | Y和Z两者最高价氧化物对应的水化物能相互反应 |
9.下列有关化学用语表示正确的是( )
| A. | 乙烯的结构简式:CH2CH2 | B. | 乙烯的分子式:C2H4 | ||
| C. | 乙酸的结构简式:C2H4O2 | D. | 丙烷分子的球棍模型是 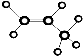 |
19.取三张蓝色石蕊试纸放在玻璃上,然后按顺序滴加65%的HNO3、98.3%H2SO4和新制氯水,三张试纸最后呈现的颜色是( )
| A. | 白、红、白 | B. | 红、黑、红 | C. | 红、红、红 | D. | 白、黑、白 |

 .
. .
.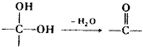 ②
② 中氯原子较难水解物质A(
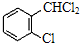
中氯原子较难水解物质A( )可由2-氯甲苯为原料制得,写出以两步制备A的化学方程式
)可由2-氯甲苯为原料制得,写出以两步制备A的化学方程式 +2Cl2
+2Cl2
 +2HCl、
+2HCl、 +2NaOH
+2NaOH
 +2NaCl+2H2O.
+2NaCl+2H2O. 和
和 .
. ,两个取代基分别在间位和对位,共3种
,两个取代基分别在间位和对位,共3种
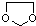 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2$\stackrel{Br_{2}}{→}$
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2$\stackrel{Br_{2}}{→}$