题目内容
7.下列各物质的化学式、对应的名称(或俗名)、物质所属的类别都正确的是( )| A. | Na2O2 过氧化钠 碱性氧化物 | B. | CO2二氧化碳 酸性氧化物 | ||
| C. | H2SO3硫酸 酸 | D. | Na2CO3 纯碱 碱 |
分析 A、碱性氧化物是能和酸反应生成盐和水的氧化物;
B、酸性氧化物是能和碱反应生成盐和水的氧化物;
C、电离出的阳离子全部是氢离子的化合物是酸;
D、电离出的阴离子全部是氢氧根的化合物是碱,据此分析.
解答 解:A、碱性氧化物是能和酸反应生成盐和水的氧化物,而Na2O2 和酸反应除了生成盐和水,还生成氧气,故不是碱性氧化物,故A错误;
B、酸性氧化物是能和碱反应生成盐和水的氧化物,而CO2能和碱反应生成盐和水,故是酸性氧化物,故B正确;
C、电离出的阳离子全部是氢离子的化合物是酸,但H2SO3是亚硫酸,不是硫酸,故C错误;
D、电离出的阴离子全部是氢氧根的化合物是碱,故Na2CO3不是碱,是盐,故D错误.
故选B.
点评 本题考查了碱性氧化物、酸性氧化物和酸碱的概念以及物质的俗称,难度不大,根据概念来判断.

练习册系列答案
相关题目
5.根据原子结构及元素周期律的知识,下列推断正确的是( )
| A. | 从HF、HCl、HBr、HI酸性递增的事实,推出F、Cl、Br、I的非金属递增的规律 | |
| B. | IA族与ⅦA族元素间可形成离子键也可形成共价键 | |
| C. | Cl-、S2-、Ca2+、K+半径逐渐减小 | |
| D. | 同周期金属元素的化合价越高,其原子失电子能力越强 |
15.下列判断中,正确的是( )
| A. | AlCl3溶液和Al2(SO4)3溶液加热蒸干,灼烧都得到Al2O3 | |
| B. | 25℃时,Mg(OH)2固体在蒸馏水、盐酸和氯化铵溶液中的Ksp大小顺序为:盐酸>氯化铵>蒸馏水 | |
| C. | 已知25℃时,NH4F溶液显酸性,则电离常数K(NH3•H2O)<K(HF) | |
| D. | 向NH4HSO4溶液中滴加NaOH溶液至中性,所得混合溶液中,c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+) |
2.研究小组分别用锌片、铝片、Cu和稀硫酸进行原电池的相关的探究,所得部分实验数琚如下,下列说法正确的是( )
| 实验 | 电极甲 | 电极乙 |
| I | Zn | Cu |
| Ⅱ | Al | Cu |
| A. | 两组实验溶液的pH均增大 | |
| B. | 实验Ⅱ中,H+向Al定向迁移 | |
| C. | 实验I中,甲电极反应为:2H++e-=H2↑ | |
| D. | 实验Ⅱ中,电子由铜转移到锌 |
12.下列反应一定能自发进行的是( )
| A. | 放热反应 | B. | 熵增加的反应 | ||
| C. | 熵增加的吸热反应 | D. | 熵增加的放热反应 |
19.取三张蓝色石蕊试纸放在玻璃上,然后按顺序滴加65%的HNO3、98.3%H2SO4和新制氯水,三张试纸最后呈现的颜色是( )
| A. | 白、红、白 | B. | 红、黑、红 | C. | 红、红、红 | D. | 白、黑、白 |
17.下面是有关弱酸的电离平衡常数.结合数据,分析下列有关说法,其中错误的是( )
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | 1 mol•L-1的溶液中,pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) | |
| B. | 升高温度,HCN溶液中H+浓度增大,平衡正向移动,电离平衡常数增大 | |
| C. | 向稀醋酸中逐滴加水,或加入少量冰醋酸,CH3COOH的电离平衡都正向移动 | |
| D. | 向CH3COOH溶液中加入少量氢氧化钠固体,平衡正向移动 |

 .
. .
.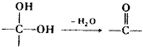 ②
② 中氯原子较难水解物质A(
中氯原子较难水解物质A( )可由2-氯甲苯为原料制得,写出以两步制备A的化学方程式
)可由2-氯甲苯为原料制得,写出以两步制备A的化学方程式 +2Cl2
+2Cl2
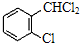 +2HCl、
+2HCl、 +2NaOH
+2NaOH
 +2NaCl+2H2O.
+2NaCl+2H2O. 和
和 .
. ,两个取代基分别在间位和对位,共3种
,两个取代基分别在间位和对位,共3种
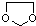 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2$\stackrel{Br_{2}}{→}$
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2$\stackrel{Br_{2}}{→}$