题目内容
14.含有相同氧原子数的NO和NO2,物质的量比为2:1,其质量比为30:23,氮原子数比为2:1.分析 NO和NO2分子分别含有1个O原子、2个O原子,含有相同氧原子数的NO和NO2,物质的量比为2:1,根据m=nM计算二者质量之比,每个分子均含有1个N原子,含有氮原子数目之比等于分子物质的量之比.
解答 解:NO和NO2分子分别含有1个O原子、2个O原子,含有相同氧原子数的NO和NO2,二者物质的量比为2:1,二者质量之比为2mol×30g/mol:1mol×46g/mol=30:23,每个分子均含有1个N原子,含有氮原子数目之比为2:1,
故答案为:2:1; 30:23; 2:1.
点评 本题考查物质的量有关计算,比较基础,有利于基础知识的巩固.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案
相关题目
4.80℃时,将0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4═2NO2△H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
①计算20s-40s内用N2O4表示的平均反应速率为0.002 mol/(L.s)
②计算在80℃时该反应的N2O4的转化率=75%此温度下NO2的体积分数=$\frac{6}{7}$,此时容器内压强与反应起始时的比值为$\frac{7}{4}$.
③反应进行至110s后将反应混合物的温度降低,混合气体的颜色变浅;如果此时加入NO2,则此时容器内颜色变深(填“变浅”、“变深”或“不变”)
④要增大该反应NO2 的体积分数,可采取的措施有(填序号)D
A.增大N2O4的起始浓度 B.通入N2气体
C.使用高效催化剂 D.升高温度.
| 时间(s) n(mol) | 0 | 20 | 40 | 60 | 80 | 110 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
②计算在80℃时该反应的N2O4的转化率=75%此温度下NO2的体积分数=$\frac{6}{7}$,此时容器内压强与反应起始时的比值为$\frac{7}{4}$.
③反应进行至110s后将反应混合物的温度降低,混合气体的颜色变浅;如果此时加入NO2,则此时容器内颜色变深(填“变浅”、“变深”或“不变”)
④要增大该反应NO2 的体积分数,可采取的措施有(填序号)D
A.增大N2O4的起始浓度 B.通入N2气体
C.使用高效催化剂 D.升高温度.
5.下列有关实验的叙述,正确的是(填序号) ( )
| A. | 用NaOH溶液除去乙酸乙酯中混有的乙酸、乙醇,然后分液 | |
| B. | 分馏石油时,温度计的末端必须插入液面下 | |
| C. | 用分液漏斗分离环己烷和水的混合液体 | |
| D. | 用浓氨水洗涤做过银镜反应的试管 | |
| E. | 配制银氨溶液时,将稀氨水慢慢滴加到稀硝酸银溶液中,产生白色沉淀后继续滴加到沉淀刚好溶解为止 |
2.常温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | 将足量CO2通入:NH4+、Na+、Al3+、NO${\;}_{3}^{-}$ | |
| B. | 在中性的水溶液中:Fe2+、K+、NO${\;}_{3}^{-}$、ClO- | |
| C. | 含有大量Al3+的溶液中:Na+、NO3-、Cl-、AlO2- | |
| D. | 水电离出的c(H+)=1×10-12mol•L-1的溶液中:Na+、Mg2+、HCO3-、SO${\;}_{4}^{2-}$ |
9.下列关于乙酸的说法中错误的是( )
| A. | 食醋中乙酸含量为3~5g/100mL | B. | 与HCOOCH3互为同分异构体 | ||
| C. | 可用分液法分离乙酸和水 | D. | 能与碳酸钠溶液反应 |
19.根据原子结构及元素周期律的知识,下列推断正确的是( )
| A. | 同周期金属元素,原子失电子能力越强,最高化合价越高 | |
| B. | 同主族的单核阴离子,其还原性越强,氢化物的稳定性越弱 | |
| C. | 第二周期元素从左到右,最高正价从+1递增到+7 | |
| D. | 第三周期非金属元素对应的含氧酸酸性从左到右依次增强 |
6.下列生活常见现象中,没有涉及化学变化的是( )
| A. |  光合作用 | B. |  炭烧取暖 | C. |  风力发电 | D. |  电解冶炼 |
3.有机物分子式为C3H6,下列叙述正确的是( )
| A. | 一定是丙烯 | B. | 可能是丙烷 | C. | 可能是丙烯 | D. | 可能是丙炔 |
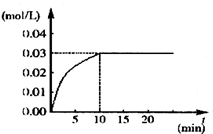 在某一容积为5L的密闭容器内,加入 0.3mol的CO和0.3mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:
在某一容积为5L的密闭容器内,加入 0.3mol的CO和0.3mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应: