题目内容
4.80℃时,将0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4═2NO2△H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:| 时间(s) n(mol) | 0 | 20 | 40 | 60 | 80 | 110 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
②计算在80℃时该反应的N2O4的转化率=75%此温度下NO2的体积分数=$\frac{6}{7}$,此时容器内压强与反应起始时的比值为$\frac{7}{4}$.
③反应进行至110s后将反应混合物的温度降低,混合气体的颜色变浅;如果此时加入NO2,则此时容器内颜色变深(填“变浅”、“变深”或“不变”)
④要增大该反应NO2 的体积分数,可采取的措施有(填序号)D
A.增大N2O4的起始浓度 B.通入N2气体
C.使用高效催化剂 D.升高温度.
分析 ①20s时△n(NO2)=0.24mol,则△c(N2O4)=$\frac{1}{2}$△n(NO2)=0.12mol,则a=0.4-0.12=0.28,再根据v=$\frac{△c}{△t}$计算v(N2O4);
②由表中数据可知,80s时反应达平衡状态,平衡时NO2为0.6mol,则:
N2O4(g)?2NO2(g)
起始量(mol):0.4 0
转化量(mol):0.3 0.6
平衡量(mol):0.1 0.6
进而计算N2O4的转化率、NO2的体积分数,恒温恒容下,压强之比等于气体物质的量之比;
③正反应为吸热反应,温度降低,平衡向逆反应方向移动,二氧化氮的浓度降低;如果此时加入NO2,平衡逆向移动,四氧化二氮浓度增大,平衡常数不变,则二氧化氮的浓度增大;
④A.增大N2O4的起始浓度,等效为增大压强,平衡逆向移动;
B.通入N2气体,恒温恒容下,反应体系各组分浓度不变,平衡不移动;
C.使用高效催化剂,不影响平衡移动;
D.正反应为吸热反应,升高温度,平衡正向移动.
解答 解:①20s时△n(NO2)=0.24mol,则△c(N2O4)=$\frac{1}{2}$△n(NO2)=0.12mol,则a=0.4-0.12=0.28,故v(N2O4)=$\frac{\frac{0.28mol-0.2mol}{2L}}{40s-20s}$=0.002mol/(L.s),故答案为:0.002;
②由表中数据可知,80s时反应达平衡状态,平衡时NO2为0.6mol,则:
N2O4(g)?2NO2(g)
起始量(mol):0.4 0
转化量(mol):0.3 0.6
平衡量(mol):0.1 0.6
则N2O4的转化率=$\frac{0.3mol}{0.4mol}$×100%=75%,NO2的体积分数=$\frac{0.6mol}{0.7mol}$=$\frac{6}{7}$,恒温恒容下,压强之比等于气体物质的量之比,故此时容器内压强与反应起始时的比值为$\frac{0.7mol}{0.4mol}$=$\frac{7}{4}$,
故答案为:75%;$\frac{6}{7}$;$\frac{7}{4}$;
③正反应为吸热反应,温度降低,平衡向逆反应方向移动,二氧化氮的浓度降低,混合气体的颜色变浅;
如果此时加入NO2,平衡逆向移动,四氧化二氮浓度增大,平衡常数不变,则二氧化氮的浓度增大,混合气体的颜色变深,
故答案为:变浅;变深;
④A.增大N2O4的起始浓度,等效为增大压强,平衡逆向移动,NO2 的体积分数减小,故A错误;
B.通入N2气体,恒温恒容下,反应体系各组分浓度不变,平衡不移动,NO2 的体积分数不变,故B错误;
C.使用高效催化剂,不影响平衡移动,NO2 的体积分数不变,故C错误;
D.正反应为吸热反应,升高温度,平衡正向移动,NO2 的体积分数增大,故D正确,
故选:D.
点评 本题考查化学平衡计算与影响因素、化学反应速率等,侧重考查学生的分析计算能力,注意对平衡移动原理的理解掌握,难度中等.

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案| A. | 纤维素 | B. | 蛋白质 | C. | 油脂 | D. | 淀粉 |
| A. | 葡萄糖 | B. | 蛋白质 | C. | 乙醇 | D. | 芝麻油 |
| A. | Cu2+、K+、Cl-、NO${\;}_{3}^{-}$ | B. | Ag+、Na+、NO${\;}_{3}^{-}$、Cl- | ||
| C. | Na+、Al3+、SO${\;}_{4}^{2-}$、Cl- | D. | Ba2+、NH${\;}_{4}^{+}$、Cl-、HCO${\;}_{3}^{-}$ |
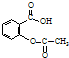 )与氢氧化钠反应可制得可溶性阿司匹林,疗效更好.写出阿司匹林与氢氧化钠的反应方程式
)与氢氧化钠反应可制得可溶性阿司匹林,疗效更好.写出阿司匹林与氢氧化钠的反应方程式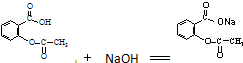 .
.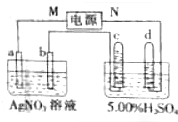 如图中电极a为Ag,电极b为Pt,电极c、d都是石墨电极.通电一段时间后,发现只有c、d两极上有气体产生,且标准状况下共收集到336mL气体.据此回答:
如图中电极a为Ag,电极b为Pt,电极c、d都是石墨电极.通电一段时间后,发现只有c、d两极上有气体产生,且标准状况下共收集到336mL气体.据此回答: