��Ŀ����
3��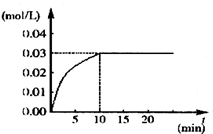 ��ijһ�ݻ�Ϊ5L���ܱ������ڣ����� 0.3mol��CO��0.3mol��H2O���ڴ������ں�800��������¼��ȣ��������·�Ӧ��
��ijһ�ݻ�Ϊ5L���ܱ������ڣ����� 0.3mol��CO��0.3mol��H2O���ڴ������ں�800��������¼��ȣ��������·�Ӧ��CO��g��+H2O��g��?CO2��g��+H2��g����
��Ӧ��CO2��Ũ����ʱ��仯�����ͼ��
��1������ͼ�����ݣ���Ӧ��ʼ���ﵽƽ��ʱ��CO�Ļ�ѧ��Ӧ����Ϊv��CO��=0.003 mol/��L•min�������¶��µ�ƽ�ⳣ��K=1��
��2��������Ϊ�жϸ÷�Ӧ�ﵽƽ��������Ǣ٢ڢܣ�������ţ�
��CO��H2O��CO2��H2��Ũ�ȶ���� �������淴Ӧ���ʶ�Ϊ��
��CO��H2O��CO2��H2��Ũ�ȶ����ٷ����仯 �ܻ��������ܶȲ��ٷ����仯
��3����Ҫһ��ʼ����0.1mol��CO��0.1mol��H2O��0.2mol��CO2��0.2mol��H2������ͬ�������£���Ӧ��ƽ��ʱ��c��CO��=0.03mol/L��
��4��427��ʱ�÷�Ӧ��ƽ�ⳣ��Ϊ9.4�����ϣ�1���еļ������ش���������¶ȸ÷�Ӧƽ����
�淴Ӧ�����ƶ���
���� ��1���ȼ��������̼��Ӧ���ʣ��ٸ���ͬһ��Ӧ��ͬһʱ����ڸ����ʵķ�Ӧ����֮�ȵ����������֮�ȼ���v��CO����
CO��g��+H2O��g��?CO2��g��+H2��g��
��ʼ��mol/L��0.06 0.06 0 0
��Ӧ��mol/L��0.03 0.03 0.03 0.03
ƽ�⣨mol/L��0.03 0.03 0.03 0.03
�÷�Ӧ��ѧƽ�ⳣ��K=$\frac{c��C{O}_{2}����c��{H}_{2}��}{c��CO����c��{H}_{2}O��}$��
��2�����淴Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ���Ӧ��ϵ�и����ʵ����ʵ������䡢���ʵ���Ũ�Ȳ��䡢�ٷֺ��������Լ��ɴ������һϵ�����������䣻
��3���¶Ȳ��䣬��ѧƽ�ⳣ�����䣬���ݻ�ѧƽ�ⳣ������ﵽƽ��״̬ʱc��CO����
��4�������¶ȣ�ƽ�������ȷ�Ӧ�����ƶ���
��� �⣺��1��v��CO2��=$\frac{0.03mol/L-0}{10min}$=0.003mol/��L��min�����ٸ���ͬһ��Ӧ��ͬһʱ����ڸ����ʵķ�Ӧ����֮�ȵ����������֮�ȵ�v��CO��v��CO2��=0.003mol/��L��min����
CO��g��+H2O��g��?CO2��g��+H2��g��
��ʼ��mol/L��0.06 0.06 0 0
��Ӧ��mol/L��0.03 0.03 0.03 0.03
ƽ�⣨mol/L��0.03 0.03 0.03 0.03
�÷�Ӧ��ѧƽ�ⳣ��K=$\frac{c��C{O}_{2}����c��{H}_{2}��}{c��CO����c��{H}_{2}O��}$=$\frac{0.03��0.03}{0.03��0.03}$=1��
�ʴ�Ϊ��0.003��1��
��2����CO��H2O��CO2��H2��Ũ�ȶ���ȣ��÷�Ӧ��һ���ﵽƽ��״̬���뷴Ӧ��ʼŨ�ȼ�ת�����йأ��ʴ���
�ڿ��淴Ӧ�ﵽƽ��״̬ʱ�������淴Ӧ������ȵ���Ϊ�㣬�ʴ���
��CO��H2O��CO2��H2��Ũ�ȶ����ٷ����仯�����淴Ӧ������ȣ��÷�Ӧ�ﵽƽ��״̬������ȷ��
�ܷ�Ӧǰ���������������䡢����������䣬���Ի��������ܶ�ʼ�ղ��䣬���ܸ����ܶ�ȷ��ƽ��״̬���ʴ���
��ѡ �٢ڢܣ�
��3����ƽ��ʱc��CO��Ϊxmol/L��
CO��g��+H2O��g��?CO2��g��+H2��g��
��ʼ��mol/L��0.02 0.02 0.04 0.04
��Ӧ��mol/L��0.02-x 0.02-x 0.02-x 0.02-x
ƽ�⣨mol/L��x x 0.06-x 0.06-x
�¶Ȳ��䣬��ѧƽ�ⳣ�����䣬���Ի�ѧƽ�ⳣ��K=$\frac{��0.06-x������0.06-x��}{x��x}$=1��
x=0.03��
�ʴ�Ϊ��0.03��
��4��800��ʱ��ѧƽ�ⳣ��KΪ1��427��ʱ�÷�Ӧ��ƽ�ⳣ��Ϊ9.4��˵�������¶�ƽ�ⳣ����С��������Ӧ�Ƿ��ȷ�Ӧ�������¶ȣ�ƽ�������ȷ�Ӧ�����ƶ�������ƽ�����淴Ӧ�����ƶ���
�ʴ�Ϊ���淴Ӧ��
���� ���⿼�黯ѧƽ���йؼ��㼰��ѧƽ��״̬�жϣ�Ϊ��Ƶ���㣬��������ʽ����������ǽⱾ��ؼ���ע�⣺��ѧƽ�ⳣ��ֻ���¶��йأ��¶Ȳ��䣬��ѧƽ�ⳣ�����䣬��Ŀ�ѶȲ���

| A�� | 0.1mol/L | B�� | 0.25mol/L | C�� | 1mol/L | D�� | 1.5mol/L |
| A�� | ԭ����ǽ�����ת��Ϊ��ѧ�ܵ�װ�� | |
| B�� | ԭ��ع���ʱ���������������ƶ� | |
| C�� | ��ӦCu+2H+=Cu2++H2������Ƴ�ԭ���װ�� | |
| D�� | п��ϡ���ᷴӦ��ȡ������������������ͭ��Һ�ܼӿ췴Ӧ���� |
| A�� | ������������������Һ̬ˮ | B�� | �Ȼ��ƹ�������ˮ | ||
| C�� | ���������Fe2O3 | D�� | ˮ����̬��ΪҺ̬ |
N2��g��+3H2��g��?2NH3��g����H��0
��1������5minʱ��Ӧ�ﵽƽ�⣬��ʱ���NH3�����ʵ���Ϊ4mol����ǰ5min��ƽ����Ӧ����v��N2��=0.2mol/��L•min����ƽ��ʱH2��ת����Ϊ50%�����¶��µ�ƽ�ⳣ��K1=$\frac{4}{27}$���÷�����ʾ��������Ӧ��ʼʱ����1molN2��3molH2ͨ�뵽���������ٴ���ƽ��ʱ��ƽ�ⳣ��ΪK2����K2=K1�����������������=����
��2��ƽ�����Ҫ���H2��ת���ʣ����Բ�ȡ�Ĵ�ʩ��C��
A�����˴���B������һ������Ne
C�����ͷ�Ӧ��ϵ���¶�D���ٳ���2mol��Ne��6mol��H2
��3���仯ѧƽ�ⳣ��K���¶�T�Ĺ�ϵ�����ʾ��
| T/�� | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
���ԱȽ�K1��K2�Ĵ�С��K1��K2�����������������=������
��400��ʱ����Ӧ2NH3��g��?N2��g��+3H2��g���Ļ�ѧƽ�ⳣ��Ϊ2��2L�������У������NH3��N2��H2���ʵ����ֱ�Ϊ6mol��4mol��2molʱ����÷�Ӧ��v��N2������v��N2���������������������=������
��4�����ݻ�ѧ��Ӧ���ʺͻ�ѧƽ�����ۣ����Ϻϳɰ�������ʵ�ʣ�����Ϊ����˵������ȷ����C
A����ѧ��Ӧ�������ۿ�ָ��������һ��ʱ���ڿ����Ʒ
B����������ԭ����ָ������ʹ������ԭ�϶����Ʒ
C��������ʹ������߲�Ʒ���ʵ���Ч����
D����ȷ���û�ѧ��Ӧ���ʺͻ�ѧ��Ӧ�����۶�����������������ۺϾ���Ч�森