题目内容
2.常温下,下列各组离子在指定溶液中能大量共存的是( )| A. | 将足量CO2通入:NH4+、Na+、Al3+、NO${\;}_{3}^{-}$ | |
| B. | 在中性的水溶液中:Fe2+、K+、NO${\;}_{3}^{-}$、ClO- | |
| C. | 含有大量Al3+的溶液中:Na+、NO3-、Cl-、AlO2- | |
| D. | 水电离出的c(H+)=1×10-12mol•L-1的溶液中:Na+、Mg2+、HCO3-、SO${\;}_{4}^{2-}$ |
分析 A.四种离子之间不反应,通入二氧化碳后也不反应;
B.亚铁离子、次氯酸根离子之间发生氧化还原反应,且二者能够水解,溶液不可能为中性;
C.铝离子与偏铝酸根离子之间发生双水解反应生成氢氧化铝沉淀;
D.水电离出的c(H+)=1×10-12mol•L-1的溶液中存在大量氢离子或氢氧根离子,镁离子、碳酸氢根离子与氢氧根离子反应,碳酸氢根离子还与氢离子反应.
解答 解:A.NH4+、Na+、Al3+、NO3-之间不发生反应,且都不与二氧化碳反应,在溶液中能够大量共存,故A正确;
B.Fe2+、ClO-之间发生氧化还原反应,且Fe2+、ClO-都能够水解,溶液不可能为中性,故B错误;
C.Al3+、AlO2-之间发生双水解反应生成氢氧化铝,在溶液中不能大量共存,故C错误;
D.水电离出的c(H+)=1×10-12mol•L-1的溶液为酸性或碱性溶液,Mg2+、HCO3-都能够与氢氧根离子反应,HCO3-与氢离子反应,在溶液中一定不能大量共存,故D错误;
故选A.
点评 本题考查离子共存的正误判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.

练习册系列答案
相关题目
12.下列物质中,不属于高分子化合物的是( )
| A. | 纤维素 | B. | 蛋白质 | C. | 油脂 | D. | 淀粉 |
7.下列有关物质的用途正确的是( )
| A. | SO2用于粉丝漂白 | B. | Al2O3用于耐高温材料 | ||
| C. | 甲醛用于食品防腐 | D. | 石灰水用于工业制漂白粉 |
11.下列实验操作或记录正确的是( )
| A. | 常温常压下测得1 mol N2的质量为28 g | |
| B. | 用量筒测得排水法收集到的氢气体积为50.28 mL | |
| C. | 用两只250 mL的容量瓶配制0.1 mol/L 500 mL的NaOH溶液 | |
| D. | 用托盘天平称得2.5 g胆矾,受热充分失水后,固体质量减轻0.9 g |
12.下列说法正确的有( )
| A. | 原电池是将电能转变为化学能的装置 | |
| B. | 原电池工作时,阳离子向负极方向移动 | |
| C. | 反应Cu+2H+=Cu2++H2↑可设计成原电池装置 | |
| D. | 锌跟稀硫酸反应制取氢气,加入少量硫酸铜溶液能加快反应速率 |
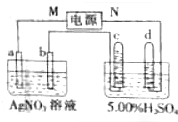 如图中电极a为Ag,电极b为Pt,电极c、d都是石墨电极.通电一段时间后,发现只有c、d两极上有气体产生,且标准状况下共收集到336mL气体.据此回答:
如图中电极a为Ag,电极b为Pt,电极c、d都是石墨电极.通电一段时间后,发现只有c、d两极上有气体产生,且标准状况下共收集到336mL气体.据此回答: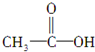 ,(请书写结构简式)则红外光谱中应该有4个振动吸收;核磁共振氢谱中应该有2个峰.
,(请书写结构简式)则红外光谱中应该有4个振动吸收;核磁共振氢谱中应该有2个峰.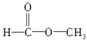 ,(请书写结构简式)则红外光谱中应该有3个振动吸收;核磁共振氢谱中应该有2个峰.
,(请书写结构简式)则红外光谱中应该有3个振动吸收;核磁共振氢谱中应该有2个峰.