题目内容
【题目】有A、B、C、D、E五种短周期元素,其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子总数;B原子最外层中有两个不成对的电子;D、E原子核内各自的质子数与中子数相等;B元素可分别与A、C、D、E生成RB2型化合物,并知在DB2和EB2中,D与B的质量比为7∶8,E与B的质量比为1∶1。试回答:
(1)写出D元素基态原子的电子排布式:____________________________________。
(2)写出AB2的路易斯结构式:__________________。
(3)B、C两元素的第一电离能大小关系为________>________(填元素符号),原因是_______________。
(4)根据VSEPR模型预测C的氢化物的立体结构为________,中心原子C的轨道杂化类型为________。
(5)C的单质分子中π键的数目为________,B、D两元素的气态氢化物的稳定性大小关系为________>________(填化学式)。
【答案】 1s22s22p63s23p2 ![]() N O N原子最外层的电子处于半充满状态,比较稳定 三角锥形 sp3杂化 2 H2O SiH4
N O N原子最外层的电子处于半充满状态,比较稳定 三角锥形 sp3杂化 2 H2O SiH4
【解析】试题分析:本题考查元素的推断,原子核外电子排布式和路易斯结构式的书写,第一电离能的比较,价层电子对互斥理论和杂化方式的判断,π键的确定和元素周期律。A原子最外层p能级的电子数等于次外层的电子总数,A为C元素;A属于第二周期,A、B、C属于同一周期,B原子最外层中有两个不成对的电子,B为O元素;B元素可与A、C、D、E生成RB2型化合物,则C为N元素;DB2中D与B的质量比为7:8,D的相对原子质量为28,D原子核内质子数与中子数相等,D的质子数为14,D为Si元素;EB2中E与B的质量比为1:1,E的相对原子质量为32,E原子核内质子数与中子数相等,E的质子数为16,E为S元素。
(1)D为Si元素,基态Si原子核外有14个电子,根据构造原理,基态硅原子的电子排布式为1s22s22p63s23p2。
(2)AB2为CO2,CO2的电子式为![]() ,结构式为O=C=O,路易斯结构式为
,结构式为O=C=O,路易斯结构式为![]() 。
。
(3)B为O元素,C为N元素,O和N两元素中第一电离能:N![]() O,原因是:N原子的价电子排布为2s22p3,N原子最外层的电子处于半充满状态,比较稳定。
O,原因是:N原子的价电子排布为2s22p3,N原子最外层的电子处于半充满状态,比较稳定。
(4)C的氢化物为NH3,N上的孤电子对数为![]() (5-3
(5-3![]() 1)=1,成键电子对数为3,价层电子对数为4,VSEPR模型为四面体,略去孤电子对,NH3的立体结构为三角锥形。中心原子N的杂化轨道类型为sp3杂化。
1)=1,成键电子对数为3,价层电子对数为4,VSEPR模型为四面体,略去孤电子对,NH3的立体结构为三角锥形。中心原子N的杂化轨道类型为sp3杂化。
(5)C的单质为N2,N2的结构式为N![]() N,三键中含1个σ键和2个π键,N2分子中有2个π键。B为O元素,D为Si元素,非金属性:O
N,三键中含1个σ键和2个π键,N2分子中有2个π键。B为O元素,D为Si元素,非金属性:O![]() Si,B、D两元素的气态氢化物稳定性:H2O
Si,B、D两元素的气态氢化物稳定性:H2O![]() SiH4。
SiH4。

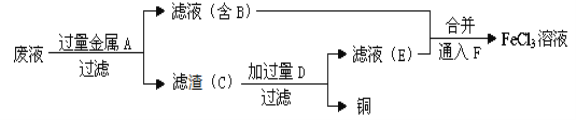
【题目】氧化锌是一种常用添加剂,广泛应用于塑料、合成橡胶、电池等产品的制造。一种利用氧化锌烟灰制备活性氧化锌的工艺流程如下:
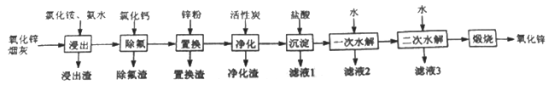
已知:I.氧化锌烟灰的主要化学组成如下:
元素组成 | Zn Pb Cu Cl F |
质量分数/% | 59.78 9.07 0.30 2.24 1.80 |
II.“浸出”时,大部分锌元素以Zn(NH3)42+ 形式进入溶液,同时部分Pb、Cu、F元素也进入溶液中。
(1)Zn的原子序数为30,其在元素周期表中的位置为__________。
(2)“浸出”时,氧化锌发生反应的离子方程式为_______________________;“浸出”时温度不宜过高,其原因为____________________________________________。
(3)若“浸出”后,所得溶液中c(F-)=0.02mol·L-1,向其中加入等体积的氯化钙溶液(忽略溶液体积变化),使F- 沉淀完全即溶液中c(F-)<10-5 mol·L-1,则所加氯化钙溶液的浓度度最小为_____________。已知:Ksp((CaF2)=3.45×10-11
(4)“置换”时,所得置换渣中除了含Zn外,还含有___________;“净化”时,利用活性炭的_________性,除去溶液中残留的有机物。
(5)“沉淀”时,可得到滤渣Zn(NH3)Cl2。所加盐酸过量时,会导致沉淀部分溶解甚至消失,其化学方程式为_________________________________。
(6)将滤液1和滤液2合并,经浓缩后,可返回至__________(填流程中的操作名称)循环利用。
(7)“一次水解”时,产物为Zn(OH)xCly,。取10.64g该水解产物,经二次水解、煅烧后,可得活性氧化锌8.1 g(假设各步均转化完全)。则一次水解产物的化学式为_____________。