题目内容
【题目】是应用最广泛的金属,铁的氯化物、氧化物均为重要化合物。
(1)工程师欲从制造印刷电路板的废水中回收铜,并获得FeCl3溶液,设计如下方案:
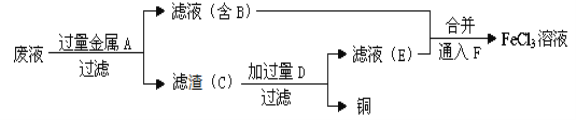
①滤渣C的化学式为_____________。
②通入F发生反应的化学方程式为_________________________。
③要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下实验操作时的最佳顺序为________。
a.加入足量氯水b.加入足量KMnO4溶液 c.加入少量KSCN溶液
A.ac B.cb C.ca D.abc
(2)四氧化三铁(Fe3O4)磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具.水热法制备Fe3O4纳米颗粒的反应是:
3Fe2++2S2O32-+O2+xOH- ═Fe3O4↓+S4O62-+2H2O.请回答下列问题.
①水热法制备Fe3O4纳米颗粒的反应中,还原剂是__________.
②反应的化学方程式中x=______.
③每生成1molFe3O4,反应转移的电子为____________mol,被Fe2+还原的O2的物质的量为______mol.
【答案】Fe、Cu 2FeCl2+Cl2=2FeCl3 C Fe2+ 和S2O32- 4 4 0.5
【解析】
(1)制取的是氯化铁溶液,金属A是铁,滤液B是氯化亚铁溶液,加入的铁过量,滤渣C是铁和铜;制取的是氯化铁,溶解铁,D加入应该是盐酸,氯化亚铁被氯气氧化为氯化铁,据以上分析解答。
(2)从电荷守恒的角度分析,可配平反应的离子方程式: 3Fe2++2S2O32-+O2+xOH- ═Fe3O4↓+S4O62-+2H2O ,反应中3Fe2+→Fe3O4,当3molFe2+参加反应时,有2molFe2+ 化合价升高,反应中Fe和S元素的化合价升高,被氧化,氧气为氧化剂,据以上分析解答。
(1)制取的是氯化铁溶液,金属A是铁;滤液B是氯化亚铁溶液;加入的铁过量,滤渣C是铁和铜;制取的是氯化铁,溶解铁,D加入应该是盐酸;氯化亚铁和氯气反应生成氯化铁,
①结合以上分析可知,滤渣C的化学式为Fe、Cu;
因此,本题正确答案是:Fe、Cu。
②结合以上分析可知,氯气能够将亚铁离子氧化成三价铁离子,反应方程式是: 2FeCl2+Cl2=2FeCl3 ;
综上所述,本题答案是:2FeCl2+Cl2=2FeCl3。
③鉴别某溶液中不含Fe3+而可能含有Fe2+的步骤为:先向溶液中加入含有KSCN的溶液,看是否有红色生成,若有红色生成则该溶液中含有Fe3+;若无红色生成,再向其中加入具有强氧化性的物质,观察是否有红色生成,若有红色生成,则该溶液中含有Fe2+。加入的氧化剂的本身颜色不能干扰该检验反应,紫红色的KMnO4溶液对于Fe3+和SCN-生成的红色物质有干扰,而黄色的氯水不会,故选ca 。
综上所述,本题选C。
(2) ①反应中Fe元素化合价部分升高为+3价,S元素化合价由+2价升高到+2.5价,则还原剂是. Fe2+ 和S2O32-;
因此,本题正确答案是: Fe2+ 和S2O32-。
②由电荷守恒可以知道,阳离子带的电荷总数等于阴离子带的负电荷总数,关系式为(+2)×3+(-2)×2+x×(-1)=-2,则x=4;
因此,本题正确答案是:4。
③Fe、S元素的化合价升高,O元素的化合价降低,由反应可以知道,该反应转移4e-,所以每生成1molFe3O4,由O元素的化合价变化可以知道,转移电子为1×2×[0-(-2)]=4,每生成1molFe3O4,消耗3molFe2+,其中有2molFe2+ 被氧化生成+3价,则被Fe2+还原的O2的物质的量为2/[2×(2-0)]=0.5mol;
因此,本题正确答案是:4,0.5。

 阅读快车系列答案
阅读快车系列答案