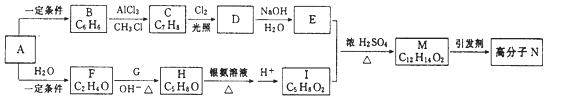
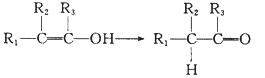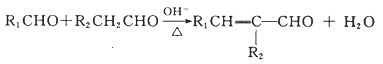题目内容
【题目】在恒容密闭容器中通入X并发生反应:2X(g)![]() Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是
Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是
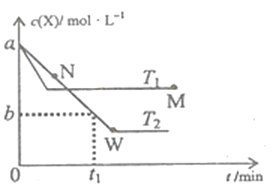
A. M点的正反应速率υ正小于N点的逆反应速率υ逆
B. T2下,在0~t1时间内,υ(Y)=![]() mol/(L·min)
mol/(L·min)
C. M点时再加入一定量X,平衡后X的转化率减小
D. 该反应进行到M点放出的热量小于进行到W点放出的热量
【答案】D
【解析】分析:用“先拐后平”法,T1优先T2出现拐点,T1达到平衡时间短、速率快,则T1![]() T2;T2平衡时c(X)小于T1,升高温度平衡向逆反应方向移动,该反应的ΔH
T2;T2平衡时c(X)小于T1,升高温度平衡向逆反应方向移动,该反应的ΔH![]() 0;利用图像上的数据和速率之比等于化学计量数之比计算υ(Y);平衡后再加入一定量X,相当于增大压强,平衡向正反应方向移动,X的平衡转化率增大。
0;利用图像上的数据和速率之比等于化学计量数之比计算υ(Y);平衡后再加入一定量X,相当于增大压强,平衡向正反应方向移动,X的平衡转化率增大。
详解:用“先拐后平”法,T1优先T2出现拐点,T1达到平衡时间短、速率快,其它条件不变时升高温度化学反应速率加快,则T1![]() T2;T2平衡时c(X)小于T1,升高温度平衡向逆反应方向移动,逆反应为吸热反应,该反应的ΔH
T2;T2平衡时c(X)小于T1,升高温度平衡向逆反应方向移动,逆反应为吸热反应,该反应的ΔH![]() 0。A项,M点是T1时的平衡点,υ正(M)=υ逆(M),N点是T2时的不平衡点,N点时的逆反应速率小于T2平衡时的逆反应速率,由于T1
0。A项,M点是T1时的平衡点,υ正(M)=υ逆(M),N点是T2时的不平衡点,N点时的逆反应速率小于T2平衡时的逆反应速率,由于T1![]() T2,T2平衡时的反应速率小于T1平衡时的反应速率,M点的正反应速率υ正大于N点的逆反应速率υ逆,A项错误;B项,T2下,0~t1时间内υ(X)=
T2,T2平衡时的反应速率小于T1平衡时的反应速率,M点的正反应速率υ正大于N点的逆反应速率υ逆,A项错误;B项,T2下,0~t1时间内υ(X)=![]() =
=![]() =
=![]() mol/(L·min),不同物质表示的化学反应速率之比等于化学计量数之比,υ(Y)=
mol/(L·min),不同物质表示的化学反应速率之比等于化学计量数之比,υ(Y)=![]() υ(X)=
υ(X)=![]() mol/(L·min),B项错误;C项,M点时再加入一定量X,相当于增大压强,平衡向正反应方向移动,平衡后X的转化率增大,C项错误;D项,该反应的正反应为放热反应,W点消耗X的物质的量大于M点,该反应进行到M点放出的热量小于进行到W点放出的热量,D项正确;答案选D。
mol/(L·min),B项错误;C项,M点时再加入一定量X,相当于增大压强,平衡向正反应方向移动,平衡后X的转化率增大,C项错误;D项,该反应的正反应为放热反应,W点消耗X的物质的量大于M点,该反应进行到M点放出的热量小于进行到W点放出的热量,D项正确;答案选D。

 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案【题目】下表中列出了有关晶体的说明,错误的是( )
选项 | A | B | C | D |
晶体名称 | 氯化钾 | 氩 | 白磷(P4) | 烧碱 |
构成晶体微粒名称 | 阴、阳离子 | 原子 | 分子 | 阴、阳离子 |
晶体中存在的作用力 | 离子键 | 共价键、范德华力 | 共价键、范德华力 | 离子键、共价键 |
A. A B. B C. C D. D
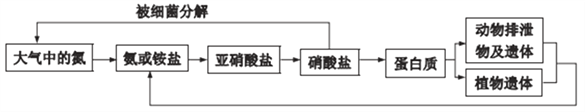
【题目】氨是动植物生长不可缺少的元素,氨在自然界中的循环对生命有重要意义。其循环示意图如下:
(1) 氨分子的电子式是__________。
(2) NH3是重要的化工原料,用途广泛,如合成尿素等。合成尿素原理分两步:
CO2(g)+ 2NH3(g)=NH2COONH4(s) △H1=- 159.5kJ/mol
NH2COONH4(s) = CO(NH2)2(s) + H2O(g) △H2=+28.5kJ/mol
则2NH3(g)+ CO2(g)=CO(NH2)2(s) + H2O(g) △H=_______kJ/mol
(3) 氯化铵也是氨的重要化合物,现有25℃时某浓度的氯化铵溶液中NH3·H2O和NH4+的浓度随pH的变化示意图如图I所示,则图中曲线①代表的是__________[填c(NH3·H2O)或c(NH4+)]该温度下NH3·H2O 电离平衡常数为___________(用a 的代数式表示)。
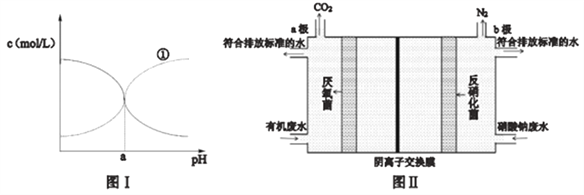
(4) 在厌氧环境下,土壤中的某些微生物(细菌)可将硝酸盐还原成氮气而实现自然界中的氮循环。某研究性学习小组由“自然界中的氮循环”产生联想:利用微生物的作用将化学能转化为电能即设计成微生物电池来同时处理含硝酸钠和有机物的废水,装置原理如图II(图中有机物用C6H12O6表示).写出电极b上的电极反应式__________________。
(5) 将游离态的氮转化为化合态的氮叫做氮的固定,其中一种重要的人工固氮就是合成氨。现维持温度为T压强为P的条件下,向一容积可变的密闭容器中通入1molN2和3molH2发生N2(g) +3H2(g)![]() 2NH3(g)的反应。容器容积与反应时间的数据关系如下表:
2NH3(g)的反应。容器容积与反应时间的数据关系如下表:
时间/min | 0 | 5 | 10 | 20 | 40 | 80 |
容器 容积/L | 4.00V | 3.20V | 2.80V | 2.60V | 2.50V | 2.50V |
该条件下达平衡时H2的转化率α(H2)=______,平衡常数K=_________(用V表示)