题目内容
【题目】钛及其化合物的应用越来越受到人们的关注。
(1)基态Ti原子核外电子排布的最高能级符号是________。与钛同周期元素中,基态原子的未成对电子数与钛相同的有_______种。
(2)钛比钢轻,比铝硬,是种新兴的结构材料。钛硬度比铝大的原因是_________
(3)催化剂M能催化乙烯、丙烯、米乙烯等的聚合,其结构如图所示。
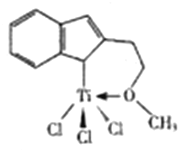
①M中,碳原子的杂化形式有__________种。
②M中,不含___________(填标号)。
a.π键 b.σ键 c.配位键 d.氢键 e.离子健
(4)金红石(TiO2)是含钛的主要矿物之一,具有典型的四方晶系结构。其晶胞结构(晶胞中相同位置的原子相同)如图所示。
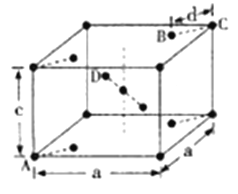
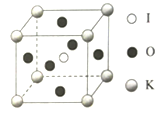
①4个微粒A、B、C、D中,属于氧原子的是______
②若A、B、C的原子坐标分别为A(0,0,0)、(0.69a,0.69a,c)、C(a,a,c),则D的原子坐标为D(0.19a,___________,_____________);钛氧键键长d=_________(用代数式表示)。
【答案】 3d 3 Ti原子的价电子数比Al多,金属键更强(或Ti的原子化热比Al大,金属键更强等) 2 d、e B、D 0.81a 0.5c 0.31×![]()
【解析】(1)Ti为22号元素,价电子排布为3d24s2,根据构造原理,最高能级为3d。Ti的基态未成对电子数为2个,同周期中未成对电子数为3个的价电子排布还有3d84s2、4s24p2、4s24p4共3种。
(2)Ti原子的价电子数比Al多,金属键更强(或Ti的原子化热比Al大,金属键更强等)
(3)①C原子的VSPER模型有正四面体和平面三角形两种,所以杂化方式有sp2和sp3两种。②该化合物中不含氢键和离子键。
(4)①通过晶胞结构可以判断出,位于体心和顶点的原子是Ti原子,Ti原子两边的原子为O原子,所以4个微粒A、B、C、D中,属于氧原子的是B、D。
②根据题意,体心Ti原子的坐标为(0.5a,0.5a,0.5c),B、C两点间的坐标差为(0.31a、0,31a、c)那么D的坐标为(0.5a-0.31a,0.5a+0.31a,0.5c)为(0.19a,0.81a,0.5c);钛氧键键长为![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案