题目内容
【题目】为測定某工业碱(组成为xNa2CO3·yNaHCO3)中Na2CO3的貭量分數,甲、乙、丙三名同学分別设计并完成了如下实验:
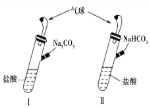
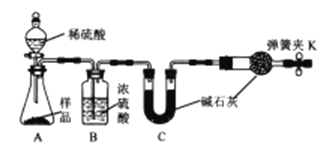
甲同学:准备称取11.40g样品利用图中装置迸行实验,反应后測定装置C中碱石灰増重5.06g。
乙同学:准确称取11.40g研细的样品,加热样品至固体完全分解,剩余固体质量为9.54g.
丙同学:准确称取11.40g样品,配成1000mL溶液,量取25.00mL溶液于锥形瓶中,加入指示剂,用0.1500mol/L标准盐酸溶被滴定至终点。完成三次平行实验后,消耗盐酸的体积平均为30.00mL。
(1)如何检查甲同学实验装置的气密性?_______________。
(2)①乙同学需要在______(填仪器名称,下同)将样品研细,在______中加热样品;
②乙同学在实验时需要将固体加热一段时间然后冷却,称量,再加热、冷却、称量,直至最后两次称量的质量差不超过0.10g,其目的是___________ 。
(3)丙同学在实验之前为了确定晶体中是否含有NaHCO3,设计了以下实验方案进行检验。
实验步骤:取少量样品于锥形瓶中加入适量蒸馏水使之溶解,加入几滴酚酞,用0.100mol/L盐酸滴定至溶液由浅红色变无色,记录消耗盐酸的体积为V1;______(填实验操作),记录消耗盐酸的体积为V2,若V2_____V1(填“<、>或=”),说明晶体中含有NaHCO3.
(4)请分析、计算后回答。
①_____同学实验结果错误,其实验失败的原因是___________。
②晶体中Na2CO3的质量分数为____________。(计算结果保留4位有效数字)
【答案】 关闭弹簧夹K,取下分液漏斗的玻璃塞并打开活塞,向分液漏斗中加水,一段时间后,分液漏斗中的水不再滴下,说明装置气密性良好,反之装置漏气 研钵 坩埚 确保NaHCO3完全分解; 再向溶液中加入几滴甲基橙溶液,继续用该盐酸溶液滴定至溶液由黄色变成橙色,且半分钟内不恢复至黄色 > 甲 有部分CO2残留在装置中,没有被C中的碱石灰吸收
【解析】(1)检查甲同学实验装置的气密性操作:关闭弹簧夹K,取下分液漏斗的玻璃塞并打开活塞,向分液漏斗中加水,一段时间后,分液漏斗中的水不再滴下,说明装置气密性良好,反之装置漏气;(2)①乙同学需要在研钵将样品研细,在坩埚中加热样品;②乙同学在实验时需要将固体加热一段时间然后冷却,称量,再加热、冷却、称量,直至最后两次称量的质量差不超过0.10g,其目的是确保NaHCO3完全分解;(3)丙同学在实验之前为了确定晶体中是否含有NaHCO3,设计了以下实验方案进行检验。实验步骤:取少量样品于锥形瓶中加入适量蒸馏水使之溶解,加入几滴酚酞,用0.100mol/L盐酸滴定至溶液由浅红色变无色,记录消耗盐酸的体积为V1;再向溶液中加入几滴甲基橙溶液,继续用该盐酸溶液滴定至溶液由黄色变成橙色,且半分钟内不恢复至黄色;记录消耗盐酸的体积为V2,碳酸钠和盐酸反应是分步进行的,离子方程式分别是CO32-+H+=HCO3-、HCO3-+H+=CO2↑+H2O,根据反应的方程式可知,如果含有碳酸氢钠,则第二次消耗的盐酸体积大于第一次消耗的盐酸体积,即V2>V1,说明晶体中含有NaHCO3;(4)①甲同学实验结果错误,其实验失败的原因是有部分CO2残留在装置中,没有被C中的碱石灰吸收,导致实验结果偏差;
②2NaHCO3![]() Na2CO3+CO2+H2O
Na2CO3+CO2+H2O ![]() m固体
m固体
168 106 168-106=62
m(NaHCO3) 11.40-9.54=1.86
m(NaHCO3)=![]() ,晶体中Na2CO3的质量分数为
,晶体中Na2CO3的质量分数为![]() 。
。

【题目】用如图所示装置进行气体x的性质实验,得出的实验结论正确的是
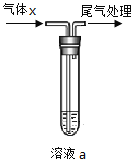
选项 | 实验操作 | 实验现象 | 实验结论 | |
制备气体x | 溶液a | |||
A | 乙醇与浓硫酸共热至170℃ | KMnO4酸性溶液 | 紫色褪去 | C2H4被氧化 |
B | 碳酸钠与醋酸溶液作用 | Na2SiO3溶液 | 产生白色沉淀 | H2CO3的酸性强于H2SiO3 |
C | 双氧水与二氧化锰作用 | KI淀粉溶液 | 溶液变蓝 | O2能将I-氧化为I2 |
D | 溴乙烷与氢氧化钠醇溶液共热 | Br2的四氯化碳溶液 | 橙红色褪去 | C2H4与Br2发生加成反应 |
A. A B. B C. C D. D