题目内容
【题目】氧化锌是一种常用添加剂,广泛应用于塑料、合成橡胶、电池等产品的制造。一种利用氧化锌烟灰制备活性氧化锌的工艺流程如下:
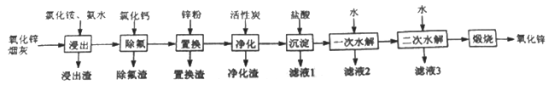
已知:I.氧化锌烟灰的主要化学组成如下:
元素组成 | Zn Pb Cu Cl F |
质量分数/% | 59.78 9.07 0.30 2.24 1.80 |
II.“浸出”时,大部分锌元素以Zn(NH3)42+ 形式进入溶液,同时部分Pb、Cu、F元素也进入溶液中。
(1)Zn的原子序数为30,其在元素周期表中的位置为__________。
(2)“浸出”时,氧化锌发生反应的离子方程式为_______________________;“浸出”时温度不宜过高,其原因为____________________________________________。
(3)若“浸出”后,所得溶液中c(F-)=0.02mol·L-1,向其中加入等体积的氯化钙溶液(忽略溶液体积变化),使F- 沉淀完全即溶液中c(F-)<10-5 mol·L-1,则所加氯化钙溶液的浓度度最小为_____________。已知:Ksp((CaF2)=3.45×10-11
(4)“置换”时,所得置换渣中除了含Zn外,还含有___________;“净化”时,利用活性炭的_________性,除去溶液中残留的有机物。
(5)“沉淀”时,可得到滤渣Zn(NH3)Cl2。所加盐酸过量时,会导致沉淀部分溶解甚至消失,其化学方程式为_________________________________。
(6)将滤液1和滤液2合并,经浓缩后,可返回至__________(填流程中的操作名称)循环利用。
(7)“一次水解”时,产物为Zn(OH)xCly,。取10.64g该水解产物,经二次水解、煅烧后,可得活性氧化锌8.1 g(假设各步均转化完全)。则一次水解产物的化学式为_____________。
【答案】 第4周期ⅡB族 ZnO+2NH3+2NH4+=Zn(NH3)42++H2O 或 ZnO+2NH3·H20+2NH4+=Zn(NH3)42++3H2O 避免氨水的分解与挥发 0.70mol·L-1 Pb、Cu 吸附 Zn(NH3)2Cl2+2HCl=ZnCl2+2NH4Cl 浸出 Zn(OH)1.6Cl0.4
【解析】(1)Zn的原子序数为30,其在元素周期表中的位置为第4周期ⅡB族。(2)“浸出”时,氧化锌发生反应的离子方程式为 ZnO+2NH3+2NH4+=Zn(NH3)42++H2O 或 ZnO+2NH3·H20+2NH4+=Zn(NH3)42++3H2O ;“浸出”时温度不宜过高,其原因为避免氨水的分解与挥发。(3)取1Lc(F-)=0.02mol·L-1浸出液,加1L氯化钙溶液,令c(Ca2+)为xmol/l,混合后溶液体积为2L,溶液中留下的n(F-)=2L×10-5 mol·L-1=2×10-5 mol,沉淀的n(F-)=0.02mol·L-1×1L-2×10-5 mol=0.02mol,沉淀的n(Ca2+)=0.01mol,Ksp((CaF2)=c(Ca2+).c2(F-)=3.45×10-11,余下的溶液中c(Ca2+)=3.45×10-11/(10-5)2=0.345mol·L-1,余下的溶液中n(Ca2+)=0.345mol·L-1×2L=0.69mol,故加入的c(Ca2+)=(0.69mol+0.01mol)/1L=0.70mol·L-1。使F- 沉淀完全即溶液中c(F-)<10-5 mol·L-1,则所加氯化钙溶液的浓度度最小为0.70mol·L-1。(4)Zn的活泼性强于Pb、Cu,“置换”时,所得置换渣中除了含Zn外,还含有Pb、Cu;“净化”时,利用活性炭的吸附性,除去溶液中残留的有机物。(5)“沉淀”时,可得到滤渣Zn(NH3)Cl2。所加盐酸过量时,会导致沉淀部分溶解甚至消失,其化学方程式为Zn(NH3)2Cl2+2HCl=ZnCl2+2NH4Cl。(6)将滤液1和滤液2合并,经浓缩后,含有氯化铵等,可返回至浸出循环利用。(7)n(ZnO)=8.1g/81g·mol-1=0.1mol,M(Zn(OH)xCly)=10.64g/0.1mol=106.4g·mol-1,x+y=2,65+17x+35.5y=10.64g,解得:x=1.6,y=0.4,则一次水解产物的化学式为Zn(OH)1.6Cl0.4

 名校课堂系列答案
名校课堂系列答案