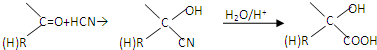
题目内容
14.下列比较中,正确的是( )| A. | 常温下,同浓度的一元酸HA比HB易电离,则相同浓度的NaA溶液比NaB溶液的pH大 | |
| B. | 0.2mol/L,NH4NO3和0.1mol/L NaOH溶液等体积混合后:c(NH4+)>c(NO3-)>c(Na+)>c(OH-)>c(H+) | |
| C. | 物质的量浓度相等的醋酸溶液和氢氧化钠溶液等体积混合:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)+c(CH3COOH) | |
| D. | 同浓度的下列溶液:①NH4Al(SO4)2 ②NH4Cl ③NH3•H2O ④CH3COONH4,其中c(NH4+)由大到小的是:①>②>④>③ |
分析 A.常温下,同浓度一元酸HA比HB易电离,说明HA的酸性大于HB,则水解程度B->A-,水解程度越大相同浓度的钠盐,其溶液的pH越大;
B.0.2 mol/LNH4NO3 和 0.l mol/L NaOH 溶液等体积混合后,二者反应生成等物质的量浓度的NaNO3、NH3.H2O、NH4NO3,溶液呈碱性,根据物料守恒判断;
C.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
D.醋酸根离子促进铵根离子水解、铝离子抑制铵根离子水解.
解答 解:A.常温下,同浓度一元酸HA比HB易电离,说明HA的酸性大于HB,则水解程度B->A-,水解程度越大相同浓度的钠盐,其溶液的pH越大,所以相同浓度NaA溶液比NaB溶液的pH小,故A错误;
B.0.2 mol/LNH4NO3和 0.l mol/L NaOH 溶液等体积混合后,二者反应生成等物质的量浓度的NaNO3、NH3.H2O、NH4NO3,溶液呈碱性,根据物料守恒得c (NO3-)>c(NH4+),故B错误;
C.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(CH3COO-)+c(OH-),则c(Na+)+c(H+)<c(CH3COO-)+c(OH-)+c(CH3COOH),故C错误;
D.醋酸根离子促进铵根离子水解、铝离子抑制铵根离子水解,一水合氨是弱电解质,相同浓度的溶液中铵根离子浓度最小,所以相同浓度的这几种溶液中c(NH4+) 由大到小的顺序是:①>②>④>③,故D正确;
故选D.
点评 本题考查了离子浓度大小比较,题目难度中等,明确溶液中的溶质及其性质是解本题关键,再结合盐类水解特点、弱电解质的电离特点及电荷守恒来分析解答.

练习册系列答案
相关题目
4.下列关于元素性质的有关叙述中不正确的是( )
| A. | C、N、O、F的原子半径依次减小 | |
| B. | Na、K、Rb、Cs的失电子能力逐渐增强 | |
| C. | C、N、O、F的最高正价依次升高 | |
| D. | Na、Mg、Al、Si的最外层电子数依次增加 |
5.用NA表示伏伽德罗常数的值,下列说法正确的是( )
| A. | 12 g14C中含有的中子数是8NA | |
| B. | 28g氮气含有的原子数是2NA | |
| C. | 1mol铁与足量稀硝酸完全反应,失去的电子数3NA | |
| D. | 标准状况下,4.48 L NO和2.24 L O2混合气体中含分子总数为0.3NA |
9.常温下,pH=11的氨水和pH=1的盐酸等体积混合后(不考虑混合后溶液体积的变化),恰好完全反应,则下列说法不正确的是( )
| A. | 弱碱的浓度大于强酸的浓度 | |
| B. | 反应后的溶液呈酸性 | |
| C. | 原氨水中有1%的含氮微粒为NH4+ | |
| D. | 反应后的溶液中NH4+、NH3•H2O与NH3为0.05mol.L-1 |
4.关于化学键的下列叙述中,正确的是( )
| A. | 离子化合物一定含共价键 | B. | 共价化合物可能含离子键 | ||
| C. | 离子化合物中只含离子键 | D. | 共价化合物中肯定不含离子键 |
 .
.
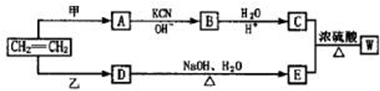
 ,若W为一高分子化合物,其结构简式为
,若W为一高分子化合物,其结构简式为 .
.