题目内容
4.关于化学键的下列叙述中,正确的是( )| A. | 离子化合物一定含共价键 | B. | 共价化合物可能含离子键 | ||
| C. | 离子化合物中只含离子键 | D. | 共价化合物中肯定不含离子键 |
分析 含有离子键的化合物属于离子化合物,离子化合物中可能含有共价键;只含有共价键的化合物属于共价化合物,共价化合物中一定没有离子键,据此分析.
解答 解:A、离子化合物中可能含共价键,如NaOH,也可能不含有共价键,如NaCl,故A错误;
B、共价化合物中只含有共价键,所以共价化合物中一定不含离子键,故B错误;
C、离子化合物中肯定含有离子键,可能含共价键,如NaOH,故C错误;
D、共价化合物中一定不含离子键,故D正确;
故选D.
点评 本题考查了离子键、共价键与离子化合物、共价化合物的关系,侧重考查学生对这几个概念的辨别能力,要注意离子化合物中可能含共价键,共价化合物中一定不含离子键.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
14.下列比较中,正确的是( )
| A. | 常温下,同浓度的一元酸HA比HB易电离,则相同浓度的NaA溶液比NaB溶液的pH大 | |
| B. | 0.2mol/L,NH4NO3和0.1mol/L NaOH溶液等体积混合后:c(NH4+)>c(NO3-)>c(Na+)>c(OH-)>c(H+) | |
| C. | 物质的量浓度相等的醋酸溶液和氢氧化钠溶液等体积混合:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)+c(CH3COOH) | |
| D. | 同浓度的下列溶液:①NH4Al(SO4)2 ②NH4Cl ③NH3•H2O ④CH3COONH4,其中c(NH4+)由大到小的是:①>②>④>③ |
12.已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOH═CH3COO-+H+,要使溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$的值增大,可以采取的措施有( )
①加少量烧碱 ②升高温度 ③加少量冰醋酸 ④加水.
①加少量烧碱 ②升高温度 ③加少量冰醋酸 ④加水.
| A. | ①② | B. | ②④ | C. | ②③④ | D. | ①④ |
19.19世纪中叶,门捷列夫的突出贡献是( )
| A. | 提出原子学说 | B. | 发现元素周期律 | C. | 提出分子学说 | D. | 最早发现了氧气 |
13.下列变化过程吸收能量的是( )
| A. | Na+→Na | B. | Cl→Cl- | C. | H+Cl→HCl | D. | H2→H+H |
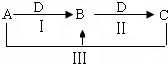 A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如下(部分反应中的水已略去).
A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如下(部分反应中的水已略去).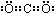
 CO2
CO2

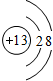 Cl
Cl .
.