题目内容
9.常温下,pH=11的氨水和pH=1的盐酸等体积混合后(不考虑混合后溶液体积的变化),恰好完全反应,则下列说法不正确的是( )| A. | 弱碱的浓度大于强酸的浓度 | |
| B. | 反应后的溶液呈酸性 | |
| C. | 原氨水中有1%的含氮微粒为NH4+ | |
| D. | 反应后的溶液中NH4+、NH3•H2O与NH3为0.05mol.L-1 |
分析 常温下,pH=11的氨水溶液和pH=1的盐酸溶液等体积混合后(不考虑混合后溶液体积的变化),恰好完全反应,反应后生成氯化铵,则c(碱)=c(酸),以此来解答.
解答 解:A.因恰好完全反应,则等体积混合时,酸碱的浓度相等,故A错误;
B.反应后生成氯化铵,水解显酸性,故B正确;
C.pH=11的氨水溶液,c(碱)=0.1mol/L,c(OH-)=c(NH4+)=10-3mol/L,则原氨水中有1%的含氮微粒为NH4+,故C正确;
D.反应后的溶液中NH4+、NH3•H2O与NH3三种微粒的平衡浓度之和为$\frac{0.1mol/L×V}{2V}$=0.05mol•L-1,故D正确;
故选A.
点评 本题考查酸碱混合溶液中离子浓度的关系,注意恰好完全反应为解答的关键,明确反应后生成氯化铵即可解答,结合物料守恒及电离即可解答,题目难度中等.

练习册系列答案
相关题目
20.有关化学用语正确的是( )
| A. | 氯化镁的电子式: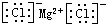 | B. | Mg2+的结构示意图: | ||
| C. | 氮气的结构式::N≡N: | D. | 18O中子数为18 |
4.一定质量的下列有机物在氧气中完全燃烧,生成二氧化碳质量与碳原子数无关的是( )
| A. | 环烷烃 | B. | 醇类 | C. | 炔烃 | D. | 油脂 |
14.下列比较中,正确的是( )
| A. | 常温下,同浓度的一元酸HA比HB易电离,则相同浓度的NaA溶液比NaB溶液的pH大 | |
| B. | 0.2mol/L,NH4NO3和0.1mol/L NaOH溶液等体积混合后:c(NH4+)>c(NO3-)>c(Na+)>c(OH-)>c(H+) | |
| C. | 物质的量浓度相等的醋酸溶液和氢氧化钠溶液等体积混合:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)+c(CH3COOH) | |
| D. | 同浓度的下列溶液:①NH4Al(SO4)2 ②NH4Cl ③NH3•H2O ④CH3COONH4,其中c(NH4+)由大到小的是:①>②>④>③ |
18.下列溶液蒸干,能得到溶质的是( )
| A. | NaHCO3 | B. | NH4Cl | C. | Al2(SO4)3 | D. | FeCl3 |
19.19世纪中叶,门捷列夫的突出贡献是( )
| A. | 提出原子学说 | B. | 发现元素周期律 | C. | 提出分子学说 | D. | 最早发现了氧气 |