题目内容
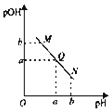
【题目】常温下,0.1 mol·L1 H2R溶液中H2R、HR、R2三者中所占物质的量分数(分布系数δ)随pH变化的关系如图所示。下列表述正确的是

A. Na2R溶液中:c(Na+)=c(HR)+2c(R2)
B. H2R![]() H++HR,Ka1=1.0×101.3
H++HR,Ka1=1.0×101.3
C. 等物质的量的NaHR和Na2R溶于水,使得溶液pH恰好为4.3
D. HF的Ka=1.0×103.4,在足量NaF溶液中加入少量H2R,发生反应:H2R+2F![]() 2HF+R2
2HF+R2
【答案】B
【解析】R2水解溶液呈碱性,c(OH)>c(H+),根据电荷守恒:c(Na+)+c(H+)=c(OH)+c(HR)+2c(R2),则c(Na+)>c(HR)+2c(R2),A项错误;电离常数只与温度有关,由图像知,当c(H2R)=c(HR)时,pH=1.3,H2R![]() H++HR,Ka1=[c(H+)·c(HR)]/c(H2R)=c(H+)=1.0×101.3,B项正确;同理可知,Ka2=1.0×104.3,等物质的量的NaHR和Na2R溶于水所得溶液呈酸性,故溶液中的c(R2)>c(HR),c(H+)<1.0×104.3 mol·L1,溶液的pH>4.3,C项错误;HF的电离常数大于H2R的电离常数Ka2,而小于Ka1,由强酸制弱酸原理可知,离子方程式为H2R+F
H++HR,Ka1=[c(H+)·c(HR)]/c(H2R)=c(H+)=1.0×101.3,B项正确;同理可知,Ka2=1.0×104.3,等物质的量的NaHR和Na2R溶于水所得溶液呈酸性,故溶液中的c(R2)>c(HR),c(H+)<1.0×104.3 mol·L1,溶液的pH>4.3,C项错误;HF的电离常数大于H2R的电离常数Ka2,而小于Ka1,由强酸制弱酸原理可知,离子方程式为H2R+F![]() HF+HR,D项错误。
HF+HR,D项错误。

【题目】已知下表为![]() 时某些弱酸的电离平衡常数。依据所给信息判断,下列说法正确的是( )
时某些弱酸的电离平衡常数。依据所给信息判断,下列说法正确的是( )
| HClO |
|
|
|
|
A.向NaClO溶液中通入少量二氧化碳的离子方程式为:![]()
B.相同浓度的![]() 和NaClO的混合溶液中,
和NaClO的混合溶液中,![]()
C.向![]() 溶液中加入少量水,溶液中pH增大
溶液中加入少量水,溶液中pH增大
D.25℃时,![]() 溶液通入
溶液通入![]() 至溶液的
至溶液的![]() 时,溶液中:
时,溶液中:![]()
【题目】某化学研究性学习小组通过查阅资料,设计了如图所示的方法以含镍废催化剂为原料来制备NiSO47H2O。已知某化工厂的含镍催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%)。

部分阳离子以氢氧化物形式完全沉淀时的pH如下:
沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
pH | 5.2 | 3.2 | 9.7 | 9.2 |
回答下列问题:
(1)操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外还需要的主要仪器为___。
(2)“碱浸”过程中发生的离子方程式是___。
(3)“酸浸”时所加入的酸是___(填化学式).酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是___。
(4)操作b为调节溶液的pH,你认为pH的最佳调控范围是___。
(5)“调pH为2~3”的目的是___。
(6)产品晶体中有时会混有少量绿矾(FeSO47H2O),其原因可能是__ 、___。