题目内容
【题目】已知下表为![]() 时某些弱酸的电离平衡常数。依据所给信息判断,下列说法正确的是( )
时某些弱酸的电离平衡常数。依据所给信息判断,下列说法正确的是( )
| HClO |
|
|
|
|
A.向NaClO溶液中通入少量二氧化碳的离子方程式为:![]()
B.相同浓度的![]() 和NaClO的混合溶液中,
和NaClO的混合溶液中,![]()
C.向![]() 溶液中加入少量水,溶液中pH增大
溶液中加入少量水,溶液中pH增大
D.25℃时,![]() 溶液通入
溶液通入![]() 至溶液的
至溶液的![]() 时,溶液中:
时,溶液中:![]()
【答案】B
【解析】
![]() 由表中数据可知酸性
由表中数据可知酸性![]() ,则碳酸的酸性强于次氯酸,将少量
,则碳酸的酸性强于次氯酸,将少量![]() 气体通入NaClO溶液中的离子方程式:
气体通入NaClO溶液中的离子方程式:![]() ,故A错误;
,故A错误;
B.相同浓度的![]() 和NaClO的混合溶液中,存在电荷守恒:
和NaClO的混合溶液中,存在电荷守恒:![]() ,物料守恒:
,物料守恒:![]() ,二者联式可得
,二者联式可得![]() ,故B正确;
,故B正确;
C.向![]() 溶液中加入少量水,醋酸钠浓度减小,溶液中氢氧根离子浓度减小,则溶液的pH减小,故C错误;
溶液中加入少量水,醋酸钠浓度减小,溶液中氢氧根离子浓度减小,则溶液的pH减小,故C错误;
D.如恰好生成![]() ,溶液中:
,溶液中:![]() ,因
,因![]() 溶液呈碱性,则呈中性时,二氧化碳应过量,则
溶液呈碱性,则呈中性时,二氧化碳应过量,则![]() ,故D错误;
,故D错误;
综上所述,答案为B。

 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=___。
(2)该反应为___反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是___(多选扣分)。
a.υ正(H2)=υ逆(H2O) b.反应停止,正、逆反应速率都等于零
c.容器中压强不再发生变化 d.混合气体中c(CO2)不变
(4)某温度下,在2L的密闭容器中,加入1 molCO2和1molH2充分反应达平衡时,CO平衡浓度为0.25mol/L,试判断此时的温度为__℃。
(5)若在(4)所处的温度下,在1L的密闭容器中,加入2molCO2和3molH2充分反应达平衡时,CO2的平衡转化率为___。
【题目】我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。
Ⅰ.已知:2CO(g) + O2(g)=2CO2(g) ΔH=-566 kJ/mol
2Fe(s) + 3/2O2(g)=Fe2O3(s) ΔH=-825.5 kJ/mol
反应:Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) ΔH=________ kJ/mol。
2Fe(s)+3CO2(g) ΔH=________ kJ/mol。
Ⅱ.反应1/3Fe2O3(s)+CO(g)![]() 2/3 Fe(s)+CO2(g)在1000℃的平衡常数等于4.0。在一容积为10 L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过10min后达到平衡。
2/3 Fe(s)+CO2(g)在1000℃的平衡常数等于4.0。在一容积为10 L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过10min后达到平衡。
(1)CO的平衡转化率为 __________。
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是 _________。
a.提高反应温度
b.增大反应体系的压强
c.选取合适的催化剂
d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
Ⅲ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下与H2反应制备甲醇: CO(g)+2H2(g)![]() CH3OH(g)。请根据图示回答下列问题:
CH3OH(g)。请根据图示回答下列问题:
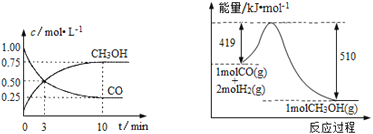
(1)从反应开始到平衡,用H2浓度变化表示平均反应速率υ(H2)=_____________。
(2)若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如下表:
容器 | 反应物投入的量 | 反应物 转化率 | CH3OH的浓度 | 能量变化 (Q1,Q2,Q3均大于0) |
甲 | 1 molCO和2 molH2 | α1 | c1 | 放出Q1 kJ热量 |
乙 | 1 molCH3OH | α2 | c2 | 吸收Q2 kJ热量 |
丙 | 2 molCO和4 molH2 | α3 | c3 | 放出Q3 kJ热量 |
则下列关系正确的是 _________(填序号)。
A.c1=c2;B.2Q1=Q3;C.2α1=α3;D.α1+α2=1;E.该反应若生成1 molCH3OH,则放出(Q1+Q2)kJ热量

