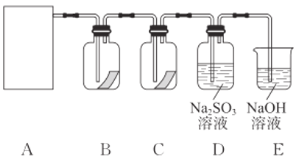
题目内容
【题目】溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、HCO3-等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是( )
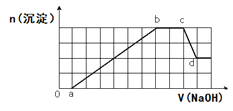
A.d点溶液中含有的溶质只有Na2SO4
B.ab段发生的离子反应为:Al3++3OH-= Al(OH)3↓, Mg2++2OH-= Mg(OH)2↓
C.原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+、Na+
D.原溶液中含有的Fe3+和Al3+的物质的量之比为1:1
【答案】D
【解析】
A.根据图象第一段,沉淀不是马上出现,可知一定有氢离子,生成沉淀在后面溶解一部分,一定有铝离子,所以d点溶液中的溶质除了Na2SO4,还含有Na[Al(OH)4],故A项错误;
B. Al3+不与HCO3共存,所以一定不含HCO3,根据第三段,和氢氧化钠反应的离子不产生沉淀,证明是铵根离子,根据坐标得生成沉淀用了6体积的氢氧化钠,其中氢氧化铝溶解用了一体积的氢氧化钠,所以形成氢氧化铝用了三体积的氢氧化钠,还有三体积的氢氧化钠一定是被三价铁离子消耗,所以一定含有三价铁离子,一定不含镁离子,所以ab段发生的离子反应为:Al3++3OH-= Al(OH)3↓,Fe3++3OH-= Fe(OH)3↓,故B错误;
C.Al3+不与HCO3共存,所以一定不含HCO3,根据第三段,和氢氧化钠反应的离子不产生沉淀,证明是铵根离子,根据坐标得生成沉淀用了6体积的氢氧化钠,其中氢氧化铝溶解用了一体积的氢氧化钠,所以形成氢氧化铝用了三体积的氢氧化钠,还有三体积的氢氧化钠一定是被三价铁离子消耗,所以一定含有三价铁离子,一定不含镁离子,即原溶液中含有的阳离子是H+、NH4+、Fe3+、Al3+,故C项错误;
D.根据坐标得生成沉淀用了6体积的氢氧化钠,其中氢氧化铝溶解用了1体积的氢氧化钠,所以形成氢氧化铝用了3体积的氢氧化钠,还有3体积的氢氧化钠一定是被三价铁离子消耗,原溶液中含有的Fe3+和Al3+的物质的量之比为1:1,故D项正确;
故答案选D。

 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案【题目】我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。
Ⅰ.已知:2CO(g) + O2(g)=2CO2(g) ΔH=-566 kJ/mol
2Fe(s) + 3/2O2(g)=Fe2O3(s) ΔH=-825.5 kJ/mol
反应:Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) ΔH=________ kJ/mol。
2Fe(s)+3CO2(g) ΔH=________ kJ/mol。
Ⅱ.反应1/3Fe2O3(s)+CO(g)![]() 2/3 Fe(s)+CO2(g)在1000℃的平衡常数等于4.0。在一容积为10 L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过10min后达到平衡。
2/3 Fe(s)+CO2(g)在1000℃的平衡常数等于4.0。在一容积为10 L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过10min后达到平衡。
(1)CO的平衡转化率为 __________。
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是 _________。
a.提高反应温度
b.增大反应体系的压强
c.选取合适的催化剂
d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
Ⅲ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下与H2反应制备甲醇: CO(g)+2H2(g)![]() CH3OH(g)。请根据图示回答下列问题:
CH3OH(g)。请根据图示回答下列问题:
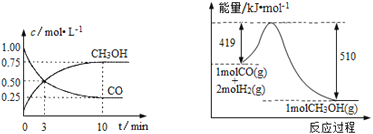
(1)从反应开始到平衡,用H2浓度变化表示平均反应速率υ(H2)=_____________。
(2)若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如下表:
容器 | 反应物投入的量 | 反应物 转化率 | CH3OH的浓度 | 能量变化 (Q1,Q2,Q3均大于0) |
甲 | 1 molCO和2 molH2 | α1 | c1 | 放出Q1 kJ热量 |
乙 | 1 molCH3OH | α2 | c2 | 吸收Q2 kJ热量 |
丙 | 2 molCO和4 molH2 | α3 | c3 | 放出Q3 kJ热量 |
则下列关系正确的是 _________(填序号)。
A.c1=c2;B.2Q1=Q3;C.2α1=α3;D.α1+α2=1;E.该反应若生成1 molCH3OH,则放出(Q1+Q2)kJ热量