题目内容
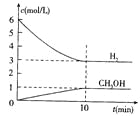
【题目】T℃时,在1 L的密闭容器中充入2 mol CO2和6mol H2,一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-49.0kJ/mol,测得H2和CH3OH(g)的浓度随时间变化如右图所示。下列说法不正确的是 ( )
CH3OH(g)+H2O(g) △H=-49.0kJ/mol,测得H2和CH3OH(g)的浓度随时间变化如右图所示。下列说法不正确的是 ( )
A.0~10min内v(H2)=0.3mol/(L·min)
B.T℃时,平衡常数K=![]() ,CO2和H2的转化率相等
,CO2和H2的转化率相等
C.T℃时,上述反应中有64g CH3OH生成,同时放出98.0kJ的热量
D.达到平衡后,升高温度或再充入CO2气体,都可以提高H2的转化率
【答案】D
【解析】
A、根据图象可知,反应进行到10min时,物质的浓度不再发生变化,说明反应达到平衡状态。此时消耗氢气的浓度是6mol/L-3mol/L=3mol/L,则用氢气表示的反应速率是0.3mol/L÷10min=0.3mol/(L·min),A正确;
B、平衡时消耗CO2的浓度是1mol/L,则平衡时CO2的浓度2mol/L-1mol/L=1mol/L,所以该温度下该反应的平衡常数K=![]() =
=![]() ,B正确;
,B正确;
C、平衡时生成甲醇的物质的量64g÷32g/mol=2mol,所以放出的热量是49.0kJ/mol×2mol=98.0kJ,C正确;
D、正方应是放热反应,则升高温度平衡向逆反应方向移动,氢气的转化率降低,D错误;
答案选D。

练习册系列答案
相关题目