题目内容
【题目】某温度下,向一定体积![]() 的醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液
的醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液![]() 与pH的变化关系如图所示,则( )
与pH的变化关系如图所示,则( )
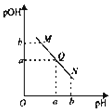
A.M点所示溶液的导电能力强于Q
B.M点的溶液显碱性,N点溶液显酸性
C.M点和N点所示溶液中水的电离程度相同
D.Q点溶液的pH一定为7
【答案】C
【解析】
酸溶液中pOH越大,说明溶液中氢氧根离子浓度越小,溶液氢离子浓度越大,酸性越强,随着NaOH的加入,发生中和反应,溶液氢氧根离子的浓度逐渐增大,则溶液pOH逐渐减小,pH逐渐增大,结合弱电解质的电离解答该题。
![]() 由于醋酸是弱酸,电离程度很小,离子浓度也较小,M点溶液的导电能力最弱,故A错误;
由于醋酸是弱酸,电离程度很小,离子浓度也较小,M点溶液的导电能力最弱,故A错误;
B.根据图象可知,N点所示溶液显碱性,则M点所示溶液显酸性,故B错误;
C.由于M点的![]() 浓度等于N点的
浓度等于N点的![]() 浓度,对水的电离程度抑制能力相同,所以两点水电离程度相同,故C正确;
浓度,对水的电离程度抑制能力相同,所以两点水电离程度相同,故C正确;
D.Q点的![]() ,溶液显中性,故只有常温下,pH为7,当温度改变时pH改变,故D错误;
,溶液显中性,故只有常温下,pH为7,当温度改变时pH改变,故D错误;
故选:C。

【题目】化学反应中不仅有物质变化而且伴随着能量变化。
(1)以下实验中属于吸热反应的是________(填序号)。
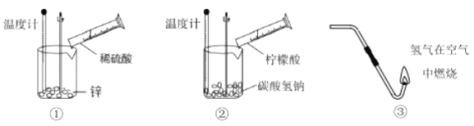
(2)下图中,表示放热反应能量变化的是_______(填字母)。
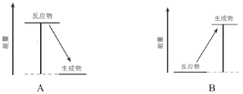
(3)从微观角度分析化学反应中能量变化的原因:

图中①和②分别为_______、_______(填“吸收”或“释放”)。氢气与氧气反应生成1mol水蒸气时,释放________kJ能量。
(4)当前,很多地区倡导用天然气替代煤作为家用燃料,根据下表从尽可能多的角度分析其原因是__。
燃料 | 燃烧释放的能量(每1千克) |
天然气 | 55812kJ |
煤 | 20908kJ |
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=___。
(2)该反应为___反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是___(多选扣分)。
a.υ正(H2)=υ逆(H2O) b.反应停止,正、逆反应速率都等于零
c.容器中压强不再发生变化 d.混合气体中c(CO2)不变
(4)某温度下,在2L的密闭容器中,加入1 molCO2和1molH2充分反应达平衡时,CO平衡浓度为0.25mol/L,试判断此时的温度为__℃。
(5)若在(4)所处的温度下,在1L的密闭容器中,加入2molCO2和3molH2充分反应达平衡时,CO2的平衡转化率为___。