题目内容
10.已知Co3+比Fe3+的氧化性更强,在水溶液中不能大量存在.(1)结合电子排布式分析Fe3+较Co3+氧化性更弱的原因:Fe3+的3d5为半充满稳定结构,所以较Co3+氧化性更弱.
(2)无水CoCl2的熔点为735℃、沸点为1049℃,FeCl3的熔点为306℃、沸点为315℃,且熔融的CoCl2能导电,熔融的FeCl3不导电.CoCl2属于离子晶体,FeCl3属于分子晶体.
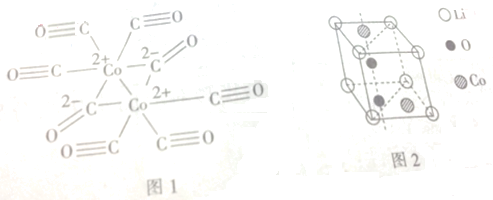
(3)Co与CO作用可生成Co2(CO)8,其结构如图1所示.该分子中含有(填“含有”或“不含”)配位键.其中C原子的杂化方式为sp、sp2.
分析 (1)Fe是26号原子,其原子核外有26个电子,失去3d上1个电子和4s上2个电子生成铁离子,根据构造原理知铁离子基态的电子排布式,同理可以写出钴离子的核外电子排布式,然后根据Fe3+的3d5为半充满稳定结构解答;
(2)分子晶体熔沸点较低且熔融不导电,离子晶体熔沸点较高且熔融能导电,据此解答;
(3)Co2+有空轨道,而CO有孤电子对,故二者可形成配位键;从结构图中可看出C有的形成两个键,有的形成3个键,故杂化类型分别为sp和sp2杂化.
解答 解:(1)Fe是26号原子,其原子核外有26个电子,失去3d上1个电子和4s上2个电子生成铁离子,根据构造原理知铁离子基态的电子排布式为1s22s22p63s23p63d5,钴是27号元素,根据构造原理可以写出钴离子的核外电子排布式为:1s22s22p63s23p63d6,Fe3+的3d5为半充满稳定结构,所以较Co3+氧化性更弱,
故答案为:Fe3+的3d5为半充满稳定结构,所以较Co3+氧化性更弱;
(2)无水CoCl2的熔沸点较高且熔融的CoCl2能导电,则CoCl2属于离子晶体,氯化铁熔沸点较低且熔融的FeCl3不导电,则氯化铁属于分子晶体,故答案为:离子;分子;
(3)Co2+有空轨道,而CO有孤电子对,故二者可形成配位键;从结构图中可看出C有的形成两个键,有的形成3个键,故杂化类型分别为sp和sp2杂化,故答案为:含有;sp、sp2.
点评 本题考查了物质结构和性质,涉及结构与性质的关系、晶体类型判断、配位键和杂化类型判断等知识点,这些知识点都是考试热点,要熟练掌握这些知识点,难点是配位键和杂化类型判断,难度中等.

练习册系列答案
相关题目
18.已知某温度下,K甲(AgCl)=1.56×10-10mol2•L-2,K甲(Ag2CrO4)=1×10-12mol3•L-3,下列叙述正确的是( )
| A. | 饱和AgCl溶液与饱和Ag2CrO4溶液相比,前者的c(Ag+)大 | |
| B. | 向氯化银的浊液中加入氯化钠溶液,氯化银的Ksp减小 | |
| C. | 向0.0008mol/L的K2CrO4溶液中加入等体积的0.002mol/LAgNO3溶液,则CrO42-完全沉淀 | |
| D. | 将0.001mol/L的AgNO3溶液滴入0.001mol/L的KCl和0.001mol/L的K2CrO4溶液,则先产生AgCl沉淀 |
15.下列有关实验装置进行的相应实验,能达到实验目的是 ( )
| A. |  该装置可模拟工业制取氯化氢 | |
| B. | 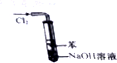 如图实验装置可以处理Cl2尾气,并防止倒吸 | |
| C. |  如图实验制取少量的Fe(OH)3胶体 | |
| D. | 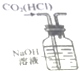 如图实验装置可除去CO2气体中含有的少量HCl杂质 |
2.用NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 1 mol过氧化钠中阴离子所带的负电荷数为NA | |
| B. | 14g乙烯和丙烯的混合物中含有的碳原子的数目为NA | |
| C. | 28g C18O与28g C16O中含有的质子数均为14NA | |
| D. | 标准状况下,22.4L氯气与足量的氢氧化钠溶液反应转移的电子数目为2NA |
19.在反应A+2HCl═MgCl2+2B中A可能是下列物质中的( )
| A. | Mg | B. | MgO | C. | Mg(OH)2 | D. | MgCO3 |
 .
. 已知A、B、C、D、E、F、G、H、I为元素周期表中原子序数依次增大的前四周期元素,A原子的最外层中p轨道上的电子数等于前一电子层电子总数;A、B、C、D;E、F与G分别位于同一周期.C原子L层上有2对成电子,D、E、F的核外电子排布相同的简单离子可形成一种E3FD6型离子晶体X,EG、HC为电子数相同的离子晶体.I原子M层为全充满状态,且核外的未成对电子只有一个.请根据以上情况,回答下列问题:(答题时,用对应的元素符号表示)
已知A、B、C、D、E、F、G、H、I为元素周期表中原子序数依次增大的前四周期元素,A原子的最外层中p轨道上的电子数等于前一电子层电子总数;A、B、C、D;E、F与G分别位于同一周期.C原子L层上有2对成电子,D、E、F的核外电子排布相同的简单离子可形成一种E3FD6型离子晶体X,EG、HC为电子数相同的离子晶体.I原子M层为全充满状态,且核外的未成对电子只有一个.请根据以上情况,回答下列问题:(答题时,用对应的元素符号表示)