题目内容
2.用NA表示阿伏伽德罗常数的值,下列说法正确的是( )| A. | 1 mol过氧化钠中阴离子所带的负电荷数为NA | |
| B. | 14g乙烯和丙烯的混合物中含有的碳原子的数目为NA | |
| C. | 28g C18O与28g C16O中含有的质子数均为14NA | |
| D. | 标准状况下,22.4L氯气与足量的氢氧化钠溶液反应转移的电子数目为2NA |
分析 A、过氧化钠是钠离子和过氧根离子构成的离子化合物;
B、乙烯和丙烯的最简式为CH2,计算14gCH2中所含碳原子数;
C、C18O与C16O的摩尔质量不同,相同质量的气体物质的量不同,质子数不同;
D、依据n=$\frac{V}{{V}_{m}}$计算气体物质的量,氯气和氢氧化钠溶液反应是氯气的自身氧化还原反应,1mol氯气反应,化合价0价变化为-1价和+1价,电子转移1mol;
解答 解:A、过氧化钠是钠离子和过氧根离子构成的离子化合物,1 mol过氧化钠中阴离子所带的负电荷数为2NA,故A错误;
B、乙烯和丙烯的最简式为CH2,计算14gCH2中所含碳原子数=$\frac{14g}{14g/mol}$×1×NA=NA,故B正确;
C、C18O与C16O的摩尔质量不同,但分子中质子数相同,相同质量的气体物质的量不同,质子数不同,故C错误;
D、依据n=$\frac{V}{{V}_{m}}$计算气体物质的量=$\frac{22.4L}{22.4L/mol}$=1mol,氯气和氢氧化钠溶液反应是氯气的自身氧化还原反应,1mol氯气反应,化合价0价变化为-1价和+1价,电子转移1mol,电子数目为NA,故D错误;
故选B.
点评 本题考查了物质结构、氧化还原反应电子转移计算、气体摩尔体积的条件应用分析,主要是物质的量的就是应用,掌握基础是关键,题目较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.向含1mol NaOH、2mol NaAl(OH)4、1mol Ba(OH)2的混合液中加入稀硫酸充分反应,加入溶质H2SO4的量和生成沉淀的量的关系正确的是( )
| 选项 | A | B | C | D |
| n(H2SO4)/mol | 2 | 3 | 4 | 5 |
| n(沉淀)/mol | 2 | 3 | 2 | 1.5 |
| A. | A | B. | B | C. | C | D. | D |
14.下列叙述正确的是( )
| A. | 同质量的H2和Cl2相比,H2的分子数少 | |
| B. | 0.5 mol 氢的质量是0.5g | |
| C. | H2SO4的摩尔质量等于98g | |
| D. | 44g CO2与28g CO所含的分子数均为NA |
7.下表为元素周期表的一部分,请回答有关问题:
(1)⑧的元素符号是Ar;单质是原子晶体的是Si;(填写元素符号,(2)小题同)
(2)表中最活泼的金属是K,单质常温下是液体的元素是Br;
(3)表中能形成两性氢氧化物的元素是Al,分别写出该元素的最高氧化物的水化物与⑥、⑨最高价氧化物的水化物反应的离子方程式:Al(OH)3+3H+=Al3++3H2O,Al(OH)3+OH-=AlO2-+2H2O;
(4)写出一个离子方程式,比较⑦、⑩单质氧化性的强弱:Cl2+2Br-=Br2+2Cl-.
| IA | ⅡA | ⅢA | ⅣA | VA | ⅥA | VIIA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
(2)表中最活泼的金属是K,单质常温下是液体的元素是Br;
(3)表中能形成两性氢氧化物的元素是Al,分别写出该元素的最高氧化物的水化物与⑥、⑨最高价氧化物的水化物反应的离子方程式:Al(OH)3+3H+=Al3++3H2O,Al(OH)3+OH-=AlO2-+2H2O;
(4)写出一个离子方程式,比较⑦、⑩单质氧化性的强弱:Cl2+2Br-=Br2+2Cl-.
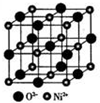 GTN{[Ni(CHZ)3](ClO4)2}是一种新型的起爆药.
GTN{[Ni(CHZ)3](ClO4)2}是一种新型的起爆药.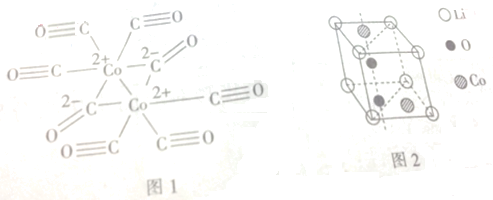
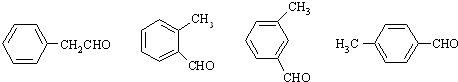 (任选一种).
(任选一种).