��Ŀ����
17��ʵ������MnO2��Ũ������ȡ��������֤�����IJ������ʣ�ʵ��װ������ͼ��ʾ��
��1��Gװ�����Ʒ�Һ©����Aװ�õķ�Ӧ�Ļ�ѧ����ʽ��MnO2+4HCl��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$MnCl2+Cl2��+2H2O����ԭ���������������ʵ���֮��Ϊ2��1��
��2��ʵ�鿪ʼ�����Ӻ�Dװ�ú첼���Ƿ���ɫ������ǡ���Eװ���й۲쵽���������ȱ�����ɫ��
��3��Bװ�õ������dz������е��Ȼ���
��4��Fװ�ú�Ӧ������һ��β������װ�ã�װ�������NaOH��Һ��β�����������ӷ�Ӧ����ʽΪCl2+2OH-�TCl-+ClO-+H2O��
���� ��1������װ��G�Ĺ���д�������ƣ�����������ʵ�����Ʒ�д����Ӧ�Ļ�ѧ����ʽ����Ӧ�ж�������Ϊ���������Ȼ���Ϊ���������μӷ�Ӧ���Ȼ�����ֻ��һ�뱻����������ԭ����
��2�����ݸ��������������Ư���ԡ�ʪ��������ܹ����ɴ����ᣬ����Ư���Խ��н�𣻸�����ˮ�������ԡ�Ư���Է�����
��3���Ȼ�����лӷ��ԣ���ȡ�������л�����Ȼ��⣬Bװ�õ����þ��dz�ȥ�����е��Ȼ��⣻
��4������������Һ��������Ӧ�����Ȼ��ơ��������ƺ�ˮ���ݴ�д����Ӧ�����ӷ���ʽ��
��� �⣺��1��A����������װ�ã��������̺����ᷴӦ�����Ȼ��̡�������ˮ����Ӧ�����ӷ���ʽΪ��MnO2+4HCl��Ũ�� $\frac{\underline{\;\;��\;\;}}{\;}$MnCl2+Cl2��+2H2O����Ӧ�ж�������Ϊ���������Ȼ���Ϊ���������μӷ�Ӧ���Ȼ�����ֻ��һ�뱻����������ԭ������ԭ���������������ʵ���֮��Ϊ2��1��
�ʴ�Ϊ����Һ©���� MnO2+4HCl��Ũ�� $\frac{\underline{\;\;��\;\;}}{\;}$MnCl2+Cl2��+2H2O�� 2��1��
��2������������������Ư���ԣ�����Dװ���и���ĺ첼������ɫ��������ˮ��Ӧ�����Ȼ���ʹ����ᣬ��Һ��ʾ���ԣ�������ɫʯ���ȱ�ɺ�ɫ�������������Ư���ԣ����Ժܿ��ɫ����ȥ��
�ʴ�Ϊ���� �ȱ�����ɫ��
��3�������ڱ���ʳ��ˮ���ܽ�Ƚ�С����ȡ�������л�����Ȼ��⣬װ��B�б���ʳ��ˮ�������dz�ȥ�����л��е������Ȼ��⣬
�ʴ�Ϊ���������е��Ȼ��⣻
��4����������Ⱦ�����壬�����ŷŵ������У���Ҫ������������Һ���գ���Ӧ�����ӷ���ʽΪ��Cl2+2OH-�TCl-+ClO-+H2O��
�ʴ�Ϊ��Cl2+2OH-�TCl-+ClO-+H2O��
���� ���⿼����������ʵ�����Ʒ��������Ļ�ѧ���ʣ���Ŀ�Ѷ��еȣ�ע������������ʵ�����Ʒ�����ȷ�����Ļ�ѧ�����ǽ����Ĺؼ����ܹ���ȷ��д������Ӧ�����ӷ���ʽ����ѧ����ʽ��

 ��ĩ�óɼ�ϵ�д�
��ĩ�óɼ�ϵ�д� 99��1������ĩ��ѵ��ϵ�д�
99��1������ĩ��ѵ��ϵ�д� ��ǿ��У��ĩ���100��ϵ�д�
��ǿ��У��ĩ���100��ϵ�д�| A�� | �����Ȼ�̼������ȡ����ˮ��Һ�е����� | |
| B�� | ����������ͬ���칹�� | |
| C�� | ��ϩ���������������ӳɷ�Ӧ��Ҳ�ɷ��������Ӿ۷�Ӧ���ɾ���ϩ | |
| D�� | ��ά�ء����ۺ͵����ʶ��Ǹ߷��ӻ����� |
| A�� | ${\;}_{2}^{3}$He����ԭ�Ӻ�����2�����Ӻ�3�����ӵĺ�ԭ�� | |
| B�� | ${\;}_{2}^{3}$He��${\;}_{2}^{4}$He�ֱ���1��2������ | |
| C�� | ${\;}_{2}^{3}$He ��${\;}_{2}^{4}$He��Ϊͬλ�� | |
| D�� | ${\;}_{2}^{3}$He������������Ϊ1������${\;}_{2}^{3}$He ���н�ǿ�Ľ����� |
��1������ˮ��Ӧ��3Fe��s��+4H2O��g��=Fe3O4��s��+4H2��g����H
��֪����3Fe��s��+2O2��g��?Fe3O4��s����H1=-1118.4kJ/mol
��2H2��g��+O2��g��?2H2O��g����H2=-483.8kJ/mol
��2H2��g��+O2��g��?2H2O��l����H3=-571.8kJ/mol
���H=-150.8KJ/mol������������һλС������
��2������t��ʱ���÷�Ӧ�ﵽƽ��״̬��û������ƽ����Է�������Ϊ$\frac{22}{3}$����Ӧ��ƽ�ⳣ��K=16��
������˵����ȷ����B������ĸ��ţ�
A��������ѹǿ�㶨����Ӧ�ﵽƽ��״̬
B�����������ܶȺ㶨����Ӧ�ﵽƽ��״̬
C�����º���ƽ���������H2���ٴ�ƽ���H2O��g���������������
D������Fe3O4�������H2O��ת����
��3�������ͷ����ں��ݾ��ȵ�װ���У����±�������ʼ���ʣ���ʼʱ��ƽ���ĸ����ʵ������±���
| Fe | H2O��g�� | Fe3O4 | H2 | |
| ��ʼ/mol | 3.0 | 4.0 | 0 | 0 |
| ƽ��/mol | m | n | p | Q |
| Fe | H2O��g�� | F3O4 | H2 | |
| A/mol | 3.0 | 4.0 | 0 | 0 |
| B/mol | 0 | 0 | 1.0 | 4.0 |
| C/mol | m | n | p | Q |
���������淴Ӧ��һ�δﵽƽ��״̬��������װ����H2����������ɴ�С��˳�����У�B��C��A����A��B��C��ʾ��
������Һ����һ���������Σ�Ϊ��ˮ��ϵ�����л������ӡ�Al2Cl7-��AlCl4-��ɵ�����Һ�������Һʱ�����ڸ���Ʒ�ϵ������
��1������ƷӦ�ӵ�Դ�ĸ�������֪��ƹ����в����������������л������Ӳ�����缫��Ӧ�������缫��ӦʽΪ4Al2Cl7-+3e-=Al+7AlCl4-��
��2��������AlCl3ˮ��Һ�����Һ����һ��ʱ���������AlO2-���ӣ������ܻ��ܣ�
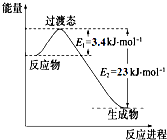
��1��CO��������������֪��Fe2O3��s��+3C��s���T2Fe��s��+3CO��g����H1=+489.0kJ•mol-1��C��s��+CO2��g���T2CO��g����H2=+172.5kJ•mol-1����CO��ԭFe2O3��s�����Ȼ�ѧ����ʽΪFe2O3��s��+3CO��g��=2Fe��s��+3CO2��g����H=-28.5kJ•mol-1��
��2��CO��O2��Ƴ�ȼ�ϵ�أ���KOH��ҺΪ���Һ�����õ�صĸ�����ӦʽΪCO+4OH--2e-=CO32-+2H2O��
��3��CO2��H2����һ������ĺ����ܱ������У��������¶��·�����Ӧ��
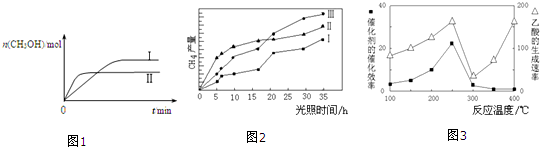
CO2��g��+3H2��g��?CH3OH��g��+H2O��g�������CH3OH�����ʵ�����ʱ��ı仯��ͼ1��
�ٸ÷�Ӧ�ġ�HС��0������ڻ�С�ڡ���������I�����Ӧ��ƽ�ⳣ����С��ϵΪK����K���������=������
��һ���¶��£����ݻ���ͬ�ҹ̶��������ܱ������У������·�ʽ���뷴Ӧ�һ��ʱ���ﵽƽ�⣮
| �ݡ����� | �� | �� |
| ��Ӧ��Ͷ���� | 1mol CO2��3mol H2 | a��mol CO2��3a��mol H2�� b��mol CH3OH��g����b��mol H2O��g�� |
��4����TiO2/Cu2Al2O4Ϊ���������Խ�CO2��CH4ֱ��ת�������ᣮ�ڲ�ͬ�¶��´����Ĵ�Ч����������������ʵĹ�ϵ��ͼ3��
�ٵ��¶���300�桫400�淶Χʱ���¶��������������ʵ���ҪӰ�����أ�
��Cu2Al2O4������ϡ���ᣬϡ���ỹԭ����ΪNO��д���йص����ӷ���ʽ3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO��+16H2O��
| A�� | CCl4 | B�� | CH3COOH | C�� | CH3CH2OH | D�� | CaCO3 |
 �о������ḻ��CO2��ȫ������Ϊ��̼Դ�������ǰӦ����㷺��̼Դ��ʯ�ͺ���Ȼ��������������Ҷ���ݽߵ�Σ����ͬʱ�ֿɻ�����CO2�ۻ�������������ЧӦ��ʵ��CO2������ѭ����
�о������ḻ��CO2��ȫ������Ϊ��̼Դ�������ǰӦ����㷺��̼Դ��ʯ�ͺ���Ȼ��������������Ҷ���ݽߵ�Σ����ͬʱ�ֿɻ�����CO2�ۻ�������������ЧӦ��ʵ��CO2������ѭ������1��Ŀǰ��ҵ����һ�ַ�������CO2��H2��230�����������ת�����ɼ״�������ˮ��������ͼ��ʾ��ѹ������0.5molCO2��1.5molH2ת���ʴ�80%ʱ�������仯ʾ��ͼ�����жϸ÷�Ӧ�ﵽ��ѧƽ��״̬��������bd��������ĸ��
a��������ѹǿ���䡡���� b��H2������������䡡����
c��c��H2��=3c��CH3OH������d���������ܶȲ���
e��2��C=O���ѵ�ͬʱ��6��H-H���ѣ�
��2������ͬ����CO��g����H2O�ֱ�ͨ�뵽���Ϊ2L�ĺ����ܱ������У����з�Ӧ��CO��g��+H2O��g��?CO2��g��+H2��g�����õ������������ݣ�
| ʵ���� | �¶� �� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min[ | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
��ʵ��3�У���ƽ��ʱ��CO��ת���ʴ���ˮ��������a/b��ֵ0��$\frac{a}{b}$��1�������ֵ��ȡֵ��Χ����
��ʵ��4����900��ʱ���ڴ������м���CO��H2O��CO2��H2��Ϊ1 molʱ�����ʱv��������v���棩���������������=������
��3����֪�ڳ��³�ѹ�£�
��2CH3OH��l��+3O2��g��=2CO2��g��+4H2O��g����H=-1275.6kJ/mol
��2CO��g��+O2��g��=2CO2��g����H=-566.0kJ/mol
��H2O��g��=H2O��l����H=-44.0kJ/mol
д���״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽ��CH3OH��l��+O2��g���TCO��g��+2H2O��l����H=-442.8kJ•mol-1��
��4����֪������һ�ֶ�Ԫ���ᣬ����������Һ�����ԣ������£���10mL��0.01mol/L H2C2O4��Һ�еμ�10mL0.01mol/L��NaOH��Һ���Ƚ���Һ�и�������Ũ�ȵĴ�С��ϵc��Na+����c��HC2O4-����c��H+����c��C2O42-����c��OH-����
��5���Լ��ѡ�����������������ҺΪԭ�ϣ�ʯīΪ�缫�ɹ���ȼ�ϵ�أ��õ�صĸ�����ӦʽΪCH3OCH3-12e-+16OH-=2CO32-+11H2O��
