题目内容
20.某科研小组为开发新型净水剂,合成中间体物质A,A可以看成由氯化铝和一种盐按物质的量之比1:2组成,有下列变化: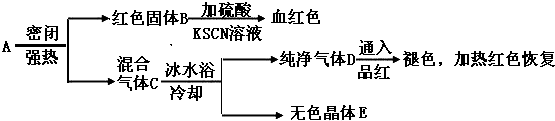
实验发现,加热4.375克A,可得到1.6克B、2.135克E和0.01mol的D.
(1)写出D的化学式SO2
(2)写出A强热发生的化学方程式AlCl3•2FeSO4$\frac{\underline{\;\;△\;\;}}{\;}$AlCl3↑+Fe2O3+SO2↑+SO3↑
(3)E晶体中某种物质在一定条件能和KI固体反应,写出该方程式SO3+2KI=I2+K2SO3
将E晶体配成溶液,逐滴加入稀NaOH溶液,现象开始无现象,然后生成白色沉淀,最终沉淀消失
(4)若在高温下长时间煅烧A,在气体D中还能检验出另一种气体,分子式是O2.
分析 根据题中各物质转化关系,红色固体B加酸溶解后遇KSCN溶液显血红色,则B为Fe2O3,所以A中含有铁元素和氧元素,D通入品红褪色,加热红色恢复,则D为SO2,A可以看成由氯化铝和一种盐按物质的量之比1:2组成,根据元素守恒可知,A中含有铁、硫、氧、氯、铝,A加热分解能生成氧化铁和二氧化硫,A中应含有的盐为FeSO4,亚铁离子与硫酸根离子在隔绝空气的条件下加热发生氧化还原反应生成Fe2O3和SO2,所以A的组成为AlCl3•2FeSO4,加热4.375克A即0.01mol,可得到1.6克Fe2O3即0.01mol和0.01mol的SO2、2.135克E,其中E含有0.01molAlCl3,即质量为1.335,根据硫元素守恒可知,其余应为0.01mol硫的氧化物,质量为0.8g,所以该氧化物为SO3,所以E为的混合物AlCl3和SO3,据此答题.
解答 解:根据题中各物质转化关系,红色固体B加酸溶解后遇KSCN溶液显血红色,则B为Fe2O3,所以A中含有铁元素和氧元素,D通入品红褪色,加热红色恢复,则D为SO2,A可以看成由氯化铝和一种盐按物质的量之比1:2组成,根据元素守恒可知,A中含有铁、硫、氧、氯、铝,A加热分解能生成氧化铁和二氧化硫,A中应含有的盐为FeSO4,亚铁离子与硫酸根离子在隔绝空气的条件下加热发生氧化还原反应生成Fe2O3和SO2,所以A的组成为AlCl3•2FeSO4,加热4.375克A即0.01mol,可得到1.6克Fe2O3即0.01mol和0.01mol的SO2、2.135克E,其中E含有0.01molAlCl3,即质量为1.335,根据硫元素守恒可知,其余应为0.01mol硫的氧化物,质量为0.8g,所以该氧化物为SO3,所以E为的混合物AlCl3和SO3,
(1)根据上面的分析可知,D为SO2,
故答案为:SO2;
(2)A强热发生的化学方程式为AlCl3•2FeSO4$\frac{\underline{\;\;△\;\;}}{\;}$AlCl3↑+Fe2O3+SO2↑+SO3↑,
故答案为:AlCl3•2FeSO4$\frac{\underline{\;\;△\;\;}}{\;}$AlCl3↑+Fe2O3+SO2↑+SO3↑;
(3)E晶体中的SO3在一定条件能和KI固体反应,该反应方程式为SO3+2KI=I2+K2SO3,将SO3晶体配成溶液,得到氯化铝和硫酸溶合溶液,逐滴加入稀NaOH溶液,氢氧化钠先与酸中和,酸反应完后再加氢氧化钠,会出现氢氧化铝沉淀,再加氢氧化钠沉淀会溶解,所以现象为开始无现象,然后生成白色沉淀,最终沉淀消失,
故答案为:SO3+2KI=I2+K2SO3;开始无现象,然后生成白色沉淀,最终沉淀消失;
(4)若在高温下长时间煅烧A,生成成的三氧化硫再分解生成二氧化硫和氧气,所以在气体D中还能检验出另一种气体,分子式是O2,
故答案为:O2;
点评 本题考查无机物的推断,题目比较综合,需要学生熟练掌握元素化合物知识,确定A的组成是解题的关键,难度较大,题目难度较大.

 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案| A. | 向NaOH溶液中通入过量CO2:2OH-+CO2=CO32-+H2O | |
| B. | 电解氯化镁溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- | |
| C. | 向H2O2溶液中加入MnO2:2H2O2+4H++MnO2=O2↑+Mn2++4H2O | |
| D. | 向KAl(SO4)2溶液中滴加Ba(OH)2溶液至SO42-沉淀完全:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O |
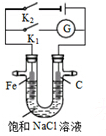
| A. | K1闭合,石墨棒上发生的反应为2H++2e→H2↑ | |
| B. | K2闭合,铁棒不会被腐蚀,属于外加电流的阴极保护法 | |
| C. | K2闭合,石墨棒周围溶液pH逐渐升高 | |
| D. | K1闭合,电路中通过0.004NA个电子时,石墨棒上产生0.001mol气体 |
| A. | 原子半径的大小顺序:r(B)>r(C)>r(D) | |
| B. | B的简单气态氢化物的热稳定性比D的弱 | |
| C. | E分别与A、C形成的化合物中化学键类型相同 | |
| D. | C的最高价氧化物对应水化物的碱性在同周期中最强 |
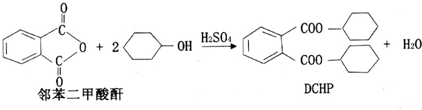
下列说法正确的是( )
| A. | DCHP的分子式为C20H28O4 | |
| B. | 上述制备DCHP的反应属于取代反应 | |
| C. | DCHP苯环上的一氯代物有4种 | |
| D. | 1 mol DCHP最多可与含4 mol NaOH的溶液反应 |
| A. | Al | B. | C | C. | O2 | D. | Fe |
| 化学方程式 | 结论 | |
| A | 4Cu0$\frac{\underline{\;高温\;}}{\;}$2Cu2O+O2↑ | 热稳定性:Cu2O>CuO |
| B | 2KClO3+I2$\frac{\underline{\;\;△\;\;}}{\;}$2KIO3+Cl2 | 非金属性:I>Cl |
| C | H2S+CuSO4═CuS↓+H2SO4 | 酸性:H2S>H2SO4 |
| D | CH3COOCH2CH3+H2O?CH3COOH+CH3CH2OH | 反应类型:既是水解反应,也是加成反应 |
| A. | A | B. | B | C. | C | D. | D |
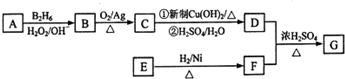
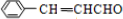 .
.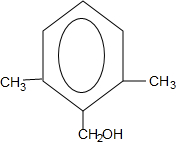 或
或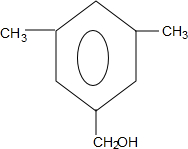 .
.


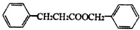 ;有机物M中含氧官能团名称是醛基.
;有机物M中含氧官能团名称是醛基.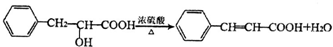 ,F→G
,F→G .
.