题目内容
20.在强碱溶液中,可能大量存在的离子组是( )| A. | Na+、K+、AlO2-、Cl- | B. | Ba2+、Na+、Al3+、SO42- | ||
| C. | K+、Mg2+、Cl-、NO3- | D. | Na+、Ca2+、Cl-、HCO3- |
分析 碱性溶液中存在大量氢氧根离子,
A.四种离子之间不反应,都不与氢氧根离子反应;
B.钡离子与硫酸根离子反应,铝离子与氢氧根离子反应;
C.镁离子与氢氧根离子反应生成氢氧化镁沉淀;
D.钙离子、碳酸氢根离子与氢氧根离子反应生成碳酸钙沉淀.
解答 解:A.Na+、K+、AlO2-、Cl-之间不反应,都不与碱性溶液中的氢氧根离子反应,在溶液中能够大量共存,故A正确;
B.Ba2+、SO42-反应生成硫酸钡,Al3+与碱性溶液中的氢氧根离子,在溶液中不能大量共存,故B错误;
C.Mg2+与碱性溶液中的氢氧根离子反应生成氢氧化镁沉淀,在溶液中不能大量共存,故C错误;
D.Ca2+、HCO3-与碱性溶液中的氢氧根离子反应生成碳酸钙,在溶液中不能大量共存,故D错误;
故选A.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间; 能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-.

练习册系列答案
 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案
相关题目
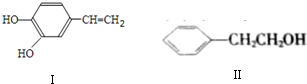
10.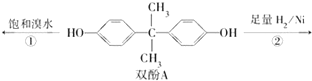 用双酚A作食品、饮料包装和奶瓶等塑料制品的添加剂,能导致人体内分泌失调,对儿童的健康危害更大.双酚A可发生如下的反应①和②,下列有关双酚A的叙述不正确的是( )
用双酚A作食品、饮料包装和奶瓶等塑料制品的添加剂,能导致人体内分泌失调,对儿童的健康危害更大.双酚A可发生如下的反应①和②,下列有关双酚A的叙述不正确的是( )
 用双酚A作食品、饮料包装和奶瓶等塑料制品的添加剂,能导致人体内分泌失调,对儿童的健康危害更大.双酚A可发生如下的反应①和②,下列有关双酚A的叙述不正确的是( )
用双酚A作食品、饮料包装和奶瓶等塑料制品的添加剂,能导致人体内分泌失调,对儿童的健康危害更大.双酚A可发生如下的反应①和②,下列有关双酚A的叙述不正确的是( )| A. | 双酚A的分子式是C15H16O2 | |
| B. | 反应①中,1 mol双酚A最多消耗2 mol Br2 | |
| C. | 双酚A的核磁共振氢谱显示氢原子数之比是1:2:2:3 | |
| D. | 反应②的产物中只有一种官能团 |
11.X22-离子共有2n个电子,元素X的原子核内的质子数为( )
| A. | n-1 | B. | n+1 | C. | n | D. | 2n |
15.随着原子序数的递增,不呈周期性变化的是元素的( )
| A. | 化合价 | B. | 相对原子质量 | ||
| C. | 原子的最外层电子排布 | D. | 原子半径 |
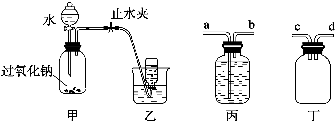
5.如图所示装置,肯定不符合气密性要求的是( )
| A. | 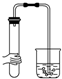 | B. |  | C. | 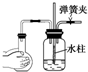 | D. | 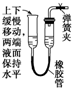 |
9.若用 NA表示阿伏加德罗常数的值,下列叙述不正确的是( )
| A. | 在0.1molNaHSO4晶体中阳离子与阴离子总数为0.2NA | |
| B. | 1L0.1mol•L-1的H2SO3溶液中含有H+的数目为0.2NA | |
| C. | 7.8gNa2O2中含有的阴离子数目为0.1NA | |
| D. | 常温常压下,14g乙烯和丙烯的混合气体中氢原子数为2NA |
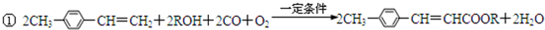
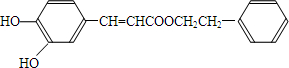 ;
;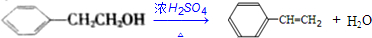 .
.