题目内容
1.用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )| A. | 常温常压下,28g CO和N2的混合气体中含有的分子总数为NA | |
| B. | 1 mol铁与足量盐酸完全反应时失去的电子数为3NA | |
| C. | 78g过氧化钠晶体中,含2NA个阴离子 | |
| D. | 标准状况下,22.4 LH2S和SO2的混合气体中含有的分子总数为NA |
分析 A、CO和氮气的摩尔质量均为28g/mol;
B、铁与盐酸反应后变为+2价;
C、求出过氧化钠的物质的量,然后根据1mol过氧化钠中含2mol钠离子和1mol过氧根来分析;
D、H2S和SO2混合后会发生归中反应.
解答 解:A、CO和氮气的摩尔质量均为28g/mol,故28g混合物的物质的量为1mol,含NA个分子,故A正确;
B、铁与盐酸反应后变为+2价,故1mol铁与盐酸反应后失去2NA个电子,故B错误;
C、78g过氧化钠的物质的量为1mol,而1mol过氧化钠中含2mol钠离子和1mol过氧根,故含NA个阴离子,故C错误;
D、H2S和SO2混合后会发生归中反应,生成硫单质和水,故分子数不是NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
11.X22-离子共有2n个电子,元素X的原子核内的质子数为( )
| A. | n-1 | B. | n+1 | C. | n | D. | 2n |
9.若用 NA表示阿伏加德罗常数的值,下列叙述不正确的是( )
| A. | 在0.1molNaHSO4晶体中阳离子与阴离子总数为0.2NA | |
| B. | 1L0.1mol•L-1的H2SO3溶液中含有H+的数目为0.2NA | |
| C. | 7.8gNa2O2中含有的阴离子数目为0.1NA | |
| D. | 常温常压下,14g乙烯和丙烯的混合气体中氢原子数为2NA |
6.人生病时要合理用药.下列药品与其作用相匹配的是( )
| A. | 氢氧化铝:麻醉剂 | B. | 阿司匹林:消炎抗菌 | ||
| C. | 麻黄碱:止咳平喘 | D. | 青霉素:解热镇痛 |
4.某温度下2L密闭容器中,3种气体起始状态和平衡状态时的物质的量(n)如下表所示.下列说法正确的是( )
| X | Y | W | |
| n(起始状态)/mol | 2 | 1 | 0 |
| n(平衡状态)/mol | 1 | 0.5 | 1.5 |
| A. | 该温度下,此反应的平衡常数表达式是K=$\frac{{c}^{2}(X)•c(Y)}{{c}^{3}(W)}$ | |
| B. | 升高温度,若W的体积分数减小,则此反应△H>0 | |
| C. | 该温度下,再向容器中通入3 mol W,达到平衡时,n(X)=2 mol | |
| D. | 若改为体积可变容器,增大压强,正、逆反应速率均增大,平衡向正反应方向移动 |
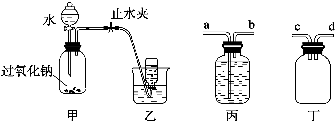
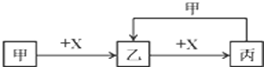
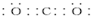 .
.
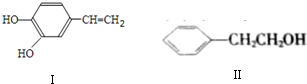
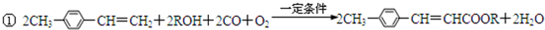
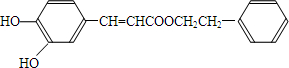 ;
;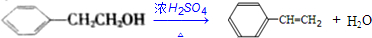 .
.