题目内容
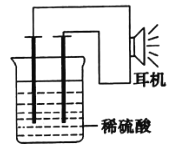
【题目】氮是地球上含量丰富的一种元素,氮元素的单质及其化合物在工农业生产、生活中有着重要作用。
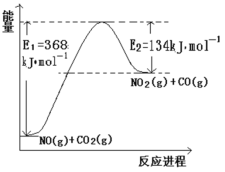
⑴根据下面能量变化示意图,请写出 NO 和 CO2反应的热化学方程式_________。
⑵在固定体积的密闭容器中,进行如下化学反应:2NH3(g)![]() N2(g)+3H2(g) △H>0,其平衡常数 K 与温度 T 的关系如下表:
N2(g)+3H2(g) △H>0,其平衡常数 K 与温度 T 的关系如下表:
T/K | 298 | 398 | 498 |
平衡常数K | 4.1×106 | K1 | K2 |
①试判断 K1_________K2(填写“>”,“<”或“=”);
②该反应的熵变S_________0(填 >、< 或 = )
③下列各项能说明该反应已达到平衡状态的是_________(填字母);
a.容器内N2、H2、NH3的物质的量之比为1∶3∶2 b.2υ(NH3)正 = 3υ(H2)逆
c.容器内混合气体平均相对分子质量保持不变 d.混合气体的密度保持不变
④一定温度下,在 1L 密闭容器中充入 1molN2和 3molH2 并发生反应。若容器容积恒定,10min 达到平衡时,气体的总物质的量为原来的9/10,则N2的转化率![]() (N2)=_________________
(N2)=_________________
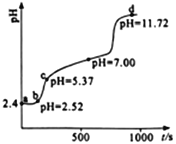
⑶对反应 N2O4(g)![]() 2NO2(g) △H > 0 ,在温度分别为T1、T2 时,平衡体系中 NO2的体积分数随压强变化曲线如右图所示,下列说法正确的是__________。
2NO2(g) △H > 0 ,在温度分别为T1、T2 时,平衡体系中 NO2的体积分数随压强变化曲线如右图所示,下列说法正确的是__________。
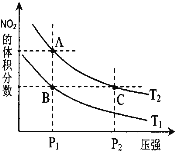
a.A、C 两点的反应速率:A>C
b.A、C 两点的化学平衡常数:A>C
c.A、C 两点 N2O4的转化率:A>C
d.由状态 B 到状态 A,可以用加热的方法
【答案】NO(g)+CO2(g) = NO2(g)+CO(g) ΔH=+234 kJ·mol1 < > c 20% c d
【解析】
⑴根据下面能量变化示意图,焓变等于反应物活化能减去生成物活化能。
⑵①该反应是吸热反应,升高温度,平衡向吸热反应即正向移动,平衡常数增大;②该反应是气体体积增加的反应,混乱程度增加;③根据判断平衡的标志的方法进行分析;④建立三段式,再根据平衡时混合气体的物质的量进行计算。
⑶根据平衡移动方法分析。
⑴根据下面能量变化示意图, NO和CO2反应的热化学方程式NO(g)+CO2(g) = NO2(g)+CO(g) ΔH=368 kJ·mol1-134 kJ·mol1=+234 kJ·mol1;故答案为:NO(g)+CO2(g) = NO2(g)+CO(g) ΔH=+234 kJ·mol1。
⑵①该反应是吸热反应,升高温度,平衡向吸热反应即正向移动,平衡常数增大,因此K1<K2;故答案为:<。
②该反应是气体体积增加的反应,混乱程度增加,因此反应的熵变S>0;故答案为:>。
③a.容器内N2、H2、NH3的物质的量之比为1∶3∶2,不能作为判断平衡标志;b.υ(NH3)正、υ(H2)逆,满足两个不同方向,但速率比不等于计量系数之比,因此不能作为判断平衡标志;c.混合气体平均相对分子质量等于气体质量除以气体物质的量,气体质量不变,气体物质的量增大,混合气体平均相对分子质量减小,当容器内混合气体平均相对分子质量保持不变,则达到平衡;d.混合气体的密度等于气体质量除以容器体积,气体质量不变,容器体积不变,密度始终不变,因此混合气体的密度保持不变,不能作为判断平衡的标志;故答案为:c。
④一定温度下,在1L密闭容器中充入1molN2和3molH2并发生反应。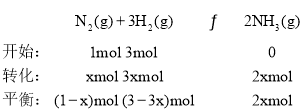 ,
,![]() ,解得x=0.2,则N2的转化率
,解得x=0.2,则N2的转化率![]() ;故答案为:20%。
;故答案为:20%。
⑶a.A、C 两点温度相同,C点压强大,因此A、C 两点的反应速率:C>A;b.A、C 两点温度相同,因此A、C 两点的化学平衡常数相同;c.从A点到C点,加压,平衡逆向移动,N2O4的转化率减小,因此A、C两点N2O4的转化率:A>C;d.B、C两点压强相同,从B到A,NO2体积分数增大,平衡正向移动,即升温,因此由状态B到状态A,可以用加热的方法得到;故答案为:cd。

 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案【题目】根据表中数据判断,下列选项结论正确的是( )
酸 | H2C2O4 | HCN | H2CO3 |
电离常数(25℃) | K1=5.4×10-2 K2=5.4×10-5 | 4.9×10-10 | K1=4.4×10-7 K2=4.7×10-11 |
A.NaCN+H2O+CO2(少量) = HCN+NaHCO3
B.0.1 molL-1的Na2CO3溶液逐渐滴加到同浓度的 HCN 溶液中,无现象,说明未发生反应
C.浓度均为 0.1 molL-1的Na2CO3、NaHCO3、NaCN、NaHC2O4溶液,pH 最大的是NaCN
D.NaHC2O4溶液中,离子浓度由大到小的顺序是c(Na+)>c(H+)>c(HC2O![]() ) >c(C2O
) >c(C2O![]() ) >c(OH-)
) >c(OH-)