题目内容
【题目】常温下,用0.1mol·L-1NaOH溶液滴定新配制的25.0mL0.02 mol·L-1FeSO4溶液,应用手持技术测定溶液的pH与时间(t)的关系,结果如右图所示。下列说法错误的是
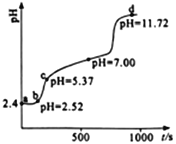
A. ab段,溶液中发生的主要反应:H++OH-=H2O
B. bc段,溶液中c(Fe2+) > (Fe3+) >c(H+)>c(OH-)
C. d点,溶液中的离子主要有Na+、SO42-、OH-
D. 滴定过程发生了复分解反应和氧化还原反应
【答案】B
【解析】A、ab段,新配制的25.0mL0.02 mol·L-1FeSO4溶液,为抑制水解加了些硫酸,溶液中发生的主要反应:H++OH-=H2O,故A正确;B. bc段,c(H+)> (Fe3+) ,故B错误;C.d点 pH =11.72,表示滴定反应已完全结束, 此时溶液含有硫酸钠与过量的氢氧化滴定反应已完全结束, 此时溶液含有硫酸钠与过量的氢氧化滴定反应已完全结束, 此时溶液含有硫酸钠与过量的氢氧化钠,溶液中的离子主要有 Na+、SO42-、OH-,C正确;D、 滴定过程中发生的反应有酸碱中和反应、硫酸亚铁与氢氧化钠的复分解反应、氢氧化亚铁与氧气的氧化还原反应,故D正确。

练习册系列答案
相关题目