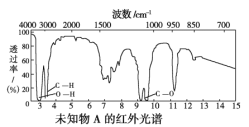
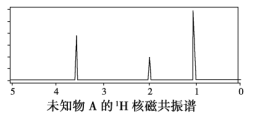
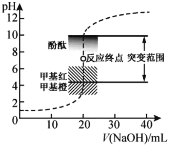
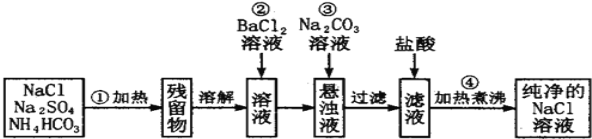
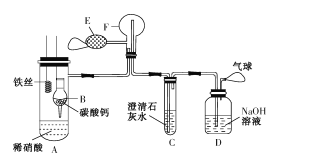
题目内容
【题目】利用生活中或实验室中的常用物品,根据氧化还原反应知识和电化学知识,自己动手设计一个原电池.请填写下列空白:
(1)实验原理:Fe+2H+=Fe2++H2↑
(2)实验用品:电极(__、__)、稀硫酸、__、__耳机(或电流计).
(3)①按如图所示装置连接好实验仪器,这时可以听见耳机发出“嚓嚓……”的声音。其原因是在原电池中化学能转化为__,在耳机中__又转化为声波这种能量。
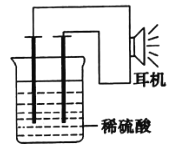
②在该原电池内中,Fe在___极发生了___反应,H+在___极发生了___反应。
【答案】铁钉(或铁条等) 铜钉(或其他的惰性电极,如铅笔芯等) 烧杯 导线 电能 电能 负 氧化 正 还原
【解析】
根据Fe+2H+═Fe2++H2↑知,铁失电子被氧化,则Fe作原电池负极,不如铁活泼的金属或导电的非金属作原电池正极,电解质溶液为弱氧化性酸溶液,结合原电池构成条件及能量转化方式分析解答。
(2)由形成原电池的条件可知,需要铁为负极,正极为铜钉(其他的惰性电极如铅笔 芯、铂等都可以),硫酸为电解质溶液,还需要烧杯、导线等,故答案为:铁钉或铁条;铜钉(其他的惰性电极如铅笔芯、铂等都可以);烧杯、导线;
(4)①在原电池中,由化学能转化为电能,在耳机中又由电能转化为声音这种能量,故答案为:电能;电能;
②如果将装置中的耳机改为电流计,则电流表指针发生偏转,形成原电池反应,铁为负极,发生氧化反应,电极方程式为Fe-2e-=Fe2+,正极发生还原反应,电极方程式为2H++2e-=H2↑,铁钉应该连接电流计的负极,铜钉连接电流计的正极,故答案为:负;氧化;正;还原。

练习册系列答案
 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案
相关题目