题目内容
14.常温下,下列各组粒子在制定溶液中一定能大量共存的是( )| A. | FeCl3溶液中:K,CH3OH,Br-,NO3- | |
| B. | 在氨水溶液中:Al3+,NO3-,Cl-,Ag+ | |
| C. | 某透明澄清的溶液中:NH4+,Fe3+,NO3-,Cl- | |
| D. | 能使甲基橙显红色的溶液:K+,Cr2O72-,CH2CH2OH,SO42- |
分析 A.金属钾能够与水反应,在溶液中不能共存;
B.银离子、铝离子能够与氨水反应;
C.四种离子之间不发生反应,且为澄清透明的溶液;
D.能使甲基橙显红色的溶液为酸性溶液,重铬酸根离子在酸性条件下具有强氧化性,能够氧化乙醇.
解答 解:A.金属钾为活泼金属,不能存在于溶液中,故A错误;
B.Al3+、Ag+都与氨水反应,在溶液中不能大量共存,故B错误;
C.NH4+,Fe3+,NO3-,Cl-之间不反应,在溶液中能够大量共存,故C正确;
D.能使甲基橙显红色的溶液为酸性溶液,Cr2O72-在酸性条件下具有强氧化性,能够氧化CH2CH2OH,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的判断,为中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;是“可能”共存,还是“一定”共存等.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
相关题目
4.短周期元素W、X、Y、Z的原子序数依次增大,其中W的阴离子的核外电子数与其他三种元素原子的内层电子数相同.X、Y均能与Z分别形成原子个数比为1:1、1:2的气态化合物.根据以上叙述,下列说法不正确的是( )
| A. | 上述气态化合物分子中所有原子最外层电子数均为8 | |
| B. | X、N、Z都可与W形成既有极性共价键又有非极性共价键的化合物 | |
| C. | 化合物W4XY2Z可能是离子化合物,也可能是共价化合物 | |
| D. | 沸点:W2Z>YW3>XW4 |
2.黑火药在适当的外界能量作用下,能进行迅速而有规律的燃烧,瞬间产生大量的热和氮气、二氧化碳等气体,由于体积急剧膨胀,压力猛烈增大,于是发生了爆炸.反应方程式为S+2KNO3+3C═K2S+N2↑+3CO2↑,下列说法不正确的是( )
| A. | S和KNO3都是反应的氧化剂 | B. | C在反应中得电子 | ||
| C. | CO2是反应的氧化产物 | D. | K2S和N2都是反应的还原产物 |
9.下列反应的方程式正确的是( )
| A. | AlCl3溶液中滴加浓氨水至过量:Al3++4NH3•H2O=AlO2-+4NH4++2H2O | |
| B. | MnO2与浓盐酸反应制取Cl2:MnO2+4H++4Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl2↑+2H2O | |
| C. | 小苏打溶液中加入足量稀盐酸:HCO3-+H+=CO2↑+H2O | |
| D. | 电解饱和食盐水的阴极反应:2Cl--2e-=Cl2↑ |
19.通过反应O2+PtF6=O2PtF6可以制得氧所形成的正价盐,经研究表明该化合物(O2PtF6)中存在阴离子PtF6-.下列说法正确的是( )
| A. | 该化合物含有离子键和共价键 | |
| B. | 1molO2参与该反应时,得到1mol电子 | |
| C. | 该化合物中阳离子与阴离子个数比为2:1 | |
| D. | O2PtF6的熔点可能比O2低 |
3.下列实验装置正确且能达到相应实验目的是( )
| A. | 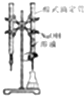 如图装置可用于已知浓度的氢氧化钠溶液滴定未知浓度的盐酸 | |
| B. |  如图装置可用于氯化铵固体和氢氧化钙固体反应制取少量氨气 | |
| C. | 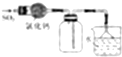 如图装置可用于收集SO2,并吸收多余的SO2 | |
| D. | 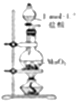 如图装置可用于制取少量Cl2 |
18.X、Y、Z、W为四种短周期主族元素,其中X、Z同族,Y、Z同周期,W是短周期主族元素中原子半径最大的,X原子最外层电子数是核外电子层数的3倍,Y的最高正价与最低负价代数和为6,下列说法正确的是( )
| A. | Y元素最高价氧化物对应水化物化学式H2YO4 | |
| B. | 原子半径由大到小的顺序为:Y>Z>X | |
| C. | X与W形成的两种化合物中,阴、阳离子物质的量之比均为1:2 | |
| D. | X、Z两种元素的气态氢化物中,Z的气态氢化物较稳定 |




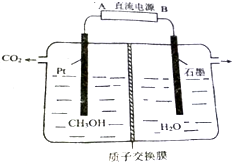 工业废水中的甲醇也可用电化学方法处理,原理如图所示.
工业废水中的甲醇也可用电化学方法处理,原理如图所示.