题目内容
18.X、Y、Z、W为四种短周期主族元素,其中X、Z同族,Y、Z同周期,W是短周期主族元素中原子半径最大的,X原子最外层电子数是核外电子层数的3倍,Y的最高正价与最低负价代数和为6,下列说法正确的是( )| A. | Y元素最高价氧化物对应水化物化学式H2YO4 | |
| B. | 原子半径由大到小的顺序为:Y>Z>X | |
| C. | X与W形成的两种化合物中,阴、阳离子物质的量之比均为1:2 | |
| D. | X、Z两种元素的气态氢化物中,Z的气态氢化物较稳定 |
分析 X、Y、Z、W为四种短周期主族元素,W是短周期主族元素中原子半径最大的,则W为Na;X原子最外层电子数是核外电子层数的3倍,原子只能有2个电子层,最外层电子数为6,故X为O元素;X、Z同族,则Z为S硫元素;Y、Z同周期,处于第三周期,Y的最高正价与最低负价代数和为6,可推知Y为Cl,结合元素周期律与元素化合物性质解答.
解答 解:X、Y、Z、W为四种短周期主族元素,W是短周期主族元素中原子半径最大的,则W为Na;X原子最外层电子数是核外电子层数的3倍,原子只能有2个电子层,最外层电子数为6,故X为O元素;X、Z同族,则Z为S硫元素;Y、Z同周期,处于第三周期,Y的最高正价与最低负价代数和为6,可推知Y为Cl.
A.Y为Cl元素,最高价氧化物对应水化物的化学式HClO4,故A错误;
B.同周期自左而右原子半径减小,电子层越多原子半径越大,故原子半径Z(S)>Y(Cl)>X(O),故B错误;
C.X与W形成的两种化合物分别为Na2O、Na2O2,氧化钠由钠离子与氧离子构成,过氧化钠由钠离子与过氧根离子构成,二者阴、阳离子物质的量之比均为1:2,故C正确;
D.氢化物稳定性与元素非金属性一致,由于O元素非金属性强于S,故O元素氢化物更稳定,故D错误,
故选C.
点评 本题考查结构性质位置关系综合应用,关键是明确元素种类,注意对元素周期律的理解掌握.

练习册系列答案
相关题目
14.常温下,下列各组粒子在制定溶液中一定能大量共存的是( )
| A. | FeCl3溶液中:K,CH3OH,Br-,NO3- | |
| B. | 在氨水溶液中:Al3+,NO3-,Cl-,Ag+ | |
| C. | 某透明澄清的溶液中:NH4+,Fe3+,NO3-,Cl- | |
| D. | 能使甲基橙显红色的溶液:K+,Cr2O72-,CH2CH2OH,SO42- |
9.某有机物m g与过量钠反应生成V L气体.该有机物m g与过量小苏打反应,生成相同状况下的气体V L.则此有机物可能是下列中的( )
| A. | HO(CH2)2CHO | B. | HO(CH2)2COOH | C. | HOOCCOOH | D. | (CH3)3CCOOH |
6.日本的核泄漏引起了人们对核能的恐慌,也加剧了人类对化石燃料的依赖,化石燃料特别是煤的使用不会加剧环境污染,工业上常把煤进行汽化、液化处理,使煤变成清洁能源,煤的一种转化流程图如图:
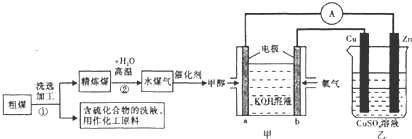
(1)随着反应的进行,乙池的电解质溶液的pH不变(填“增大、减小、不变”);甲池中负极的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O.
(2)已知在常温常压下:①CH3OH(l)+3O2(g)=2CO2(g)+4H2O△H=-1451.6kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H═-442.8kJ/mol.
(3)C(s)和H2O(g)在一定条件下反应可得到H2等清洁燃料.将不同量的C(s)和H2O(g)分别加入到体积为2L的恒容密闭容器中发生反应:C(s)+H2O(g)?CO(g)+H2(g),不同温度下得到三组数据:
①实验2条件下平衡常数K=0.75;若实验2中分离出1molH2O(g),则H2O(g)的转化率将增大(填“增大、减小、不变”);
②若实验3起始时充入的是CO(g)和H2(g),且达平衡时实验2、3中CO的体积分数相同,则起始时c(H2)==1.5mol/L.

(1)随着反应的进行,乙池的电解质溶液的pH不变(填“增大、减小、不变”);甲池中负极的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O.
(2)已知在常温常压下:①CH3OH(l)+3O2(g)=2CO2(g)+4H2O△H=-1451.6kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H═-442.8kJ/mol.
(3)C(s)和H2O(g)在一定条件下反应可得到H2等清洁燃料.将不同量的C(s)和H2O(g)分别加入到体积为2L的恒容密闭容器中发生反应:C(s)+H2O(g)?CO(g)+H2(g),不同温度下得到三组数据:
| 实验组 | 温度/C | 起始量/mol | 平衡量/mol | 达平衡所需时间/min | ||
| C | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | … | 6 |
| 2 | 900 | 6 | 3 | … | 1.5 | 3 |
| 3 | 900 | … | … | … | … | 1 |
②若实验3起始时充入的是CO(g)和H2(g),且达平衡时实验2、3中CO的体积分数相同,则起始时c(H2)==1.5mol/L.
13.从下列实验事实所得出的相应结论正确的是( )
| 实验事实 | 结论 | |
| ① | 将某气体通入品红溶液中,品红溶液褪色 | 该气体一定是SO2 |
| ② | 将燃烧的镁条放入CO2中能继续燃烧 | 还原性:Mg>C |
| ③ | NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 | 酸性:HCO3->Al(OH)3 |
| ④ | 常温下白磷自燃而氮气在放电时才与氧气反应 | 非金属性:P>N |
| ⑤ | 某无色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝 | 该溶液一定有NH4+ |
| A. | ①②③ | B. | ①③⑤ | C. | ②③⑤ | D. | ③④⑤ |
3.下列溶液中粒子的物质的量浓度关系一定正确的是( )
| A. | 常温下,pH=9的NaHA溶液:c(Na+)>c(HA-)>c(A2-)c(H2A) | |
| B. | Na2CO3溶液:c(H+)-c(OH-)=c(HCO3-)+2c(CO32-)-c(Na+) | |
| C. | 向NaOH溶液中滴入HCOOH溶液后溶液显碱性:c(HCOO-)>c(OH-)>c(H+) | |
| D. | 浓度均为0.1mol•L-1HF溶液与0.1mol•L-1KF溶液等体积混合:c(F-)+c(HF)=0.2mol•L-1 |
8.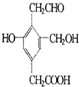 某有机物的结构简式如图,若等物质的量的该有机物分别与Na、NaOH、Na2CO3、NaHCO3恰好反应时,则消耗Na、NaOH、Na2CO3、NaHCO3的物质的量之比是( )
某有机物的结构简式如图,若等物质的量的该有机物分别与Na、NaOH、Na2CO3、NaHCO3恰好反应时,则消耗Na、NaOH、Na2CO3、NaHCO3的物质的量之比是( )
 某有机物的结构简式如图,若等物质的量的该有机物分别与Na、NaOH、Na2CO3、NaHCO3恰好反应时,则消耗Na、NaOH、Na2CO3、NaHCO3的物质的量之比是( )
某有机物的结构简式如图,若等物质的量的该有机物分别与Na、NaOH、Na2CO3、NaHCO3恰好反应时,则消耗Na、NaOH、Na2CO3、NaHCO3的物质的量之比是( )| A. | 3:3:2:1 | B. | 6:4:3:2 | C. | 1:1:1:1 | D. | 3:2:2:1 |
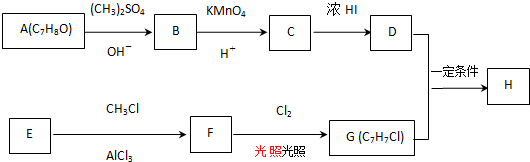
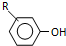 $→_{OH-}^{(CH_{3})_{2}SO_{4}}$
$→_{OH-}^{(CH_{3})_{2}SO_{4}}$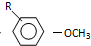 $\stackrel{浓HI}{→}$
$\stackrel{浓HI}{→}$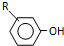
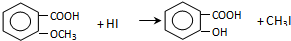 .
.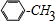 +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$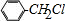 +HCl,反应类型为取代反应.
+HCl,反应类型为取代反应.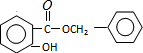 .
. (或
(或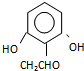 ).
).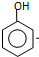 $\stackrel{反应条件1}{→}$I$→_{OH-}^{(CH_{3})_{2}SO_{4}}$J$\stackrel{反应条件2}{→}$K$\stackrel{反应条件3}{→}$
$\stackrel{反应条件1}{→}$I$→_{OH-}^{(CH_{3})_{2}SO_{4}}$J$\stackrel{反应条件2}{→}$K$\stackrel{反应条件3}{→}$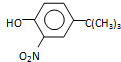 反应条件1所用的试剂为(CH3)3CCl/AlCl3,K的结构简式为
反应条件1所用的试剂为(CH3)3CCl/AlCl3,K的结构简式为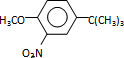 ,反应条件3所用的试剂为浓HI.
,反应条件3所用的试剂为浓HI.