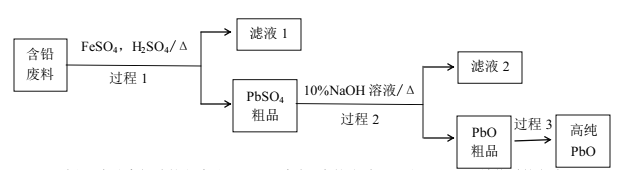
题目内容
【题目】I、300℃时,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应:X(g)+Y(g)2Z(g)ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
(1)反应0~2minZ的平均速率v(Z)=____
(2)能判断该反应已经达到平衡状态的是____
A.生成X的速率是生成Z的速率的2倍 B.容器内压强保持不变
C.容器内气体的密度保持不变 D.容器内各气体的浓度保持不变
(3)温度为300℃时,该反应的化学平衡常数K= ___
II、(1)常温下,0.005mol·L-1Ba(OH)2溶液的pH=_____
(2)常温下,向0.1mol·L-1NH3·H2O溶液中不断加水,过程中c(OH-)/c(NH3·H2O)将____(选填“增大”、“减小”或“不变”)
(3)下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)
Fe3+ | Al3+ | Zn2+ | |
开始沉淀的pH | 1.1 | 3.2 | 5.9 |
完全沉淀的pH | 3.2 | 5 | 8.9 |
某溶液中含Fe3+、Al3+、Zn2+,欲除去Fe3+、Al3+,向其中滴加1.0moL·L-1的NaOH溶液调节溶液的pH为___。
【答案】0.004mol·L-1·min-1 D 1.44 12 增大 5~5.9或其间的一个值
【解析】
I.(1)2min内Y物质的量变化为0.16mol-0.12mol=0.04mol,根据v=![]() 计算v(Y),再利用速率之比等于化学计量数之比计算v(Z);
计算v(Y),再利用速率之比等于化学计量数之比计算v(Z);
(2)结合平衡状态的特征判断即可;
(3) 由表中数据可知7min时,反应到达平衡,根据平衡时Y的物质的量,计算平衡时其它组分的物质的量,由于反应气体氢气的化学计量数相等,用物质的量代替浓度代入平衡常数表达式K=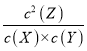 计算;
计算;
II.(1) 常温下,Kw=1×10-14,0.005mol·L-1Ba(OH)2溶液中c(OH-)=0.01 mol·L-1,c(H+)=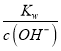 ;
;
(2)向0.1mol·L-1NH3·H2O溶液中不断加水,促进NH3·H2O的电离,溶液中c(OH-)和c(NH3·H2O)均减小,但n(OH-)的数目增多,而n(NH3·H2O)数目减小;
(3) 根据表中数据分析Fe3+、Al3+沉淀完全时溶液的pH,Zn2+开始沉淀时的pH,确定调节溶液的pH范围。
I.(1) 2min内Y物质的量变化为0.16mol-0.12mol=0.04mol,则v(Y)= =0.002mol/(Lmin),速率之比等于化学计量数之比,v(Z)=2v(Y)=0.004 mol/(Lmin);
=0.002mol/(Lmin),速率之比等于化学计量数之比,v(Z)=2v(Y)=0.004 mol/(Lmin);
(2) A.生成Z的速率(为正反应)是生成X的速率(为逆反应)的2倍,反应达到平衡状态,而题给信息,速率之比不等于系数比,反应没有达到平衡状态,故A错误;
B.恒温恒容下,反应前后气体物质的量不变,容器内压强始终保持不变,故B错误;
C.混合气体总质量不变,容器容积不变,容器内气体的密度始终保持不变,故C错误;
D.容器内各气体的浓度保持不变,说明反应到达平衡,故D正确;
故答案为D;
(3) 由表中数据可知7min时,反应到达平衡,平衡时Y的物质的量为0.1mol,则:
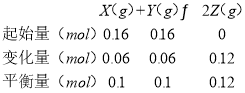
由于反应前后气体的化学计量数相等,用物质的量代替浓度计算,平衡常数K=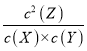 =
=![]() =1.44;
=1.44;
II、(1) 常温下,Kw=1×10-14,0.005mol·L-1Ba(OH)2溶液中c(OH-)=0.01 mol·L-1,c(H+)=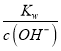 =1×10-12 mol·L-1,则溶液的pH=12;
=1×10-12 mol·L-1,则溶液的pH=12;
(2) 向0.1mol·L-1NH3·H2O溶液中不断加水,促进NH3·H2O的电离,溶液中c(OH-)和c(NH3·H2O)均减小,但n(OH-)的数目增多,而n(NH3·H2O)数目减小,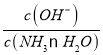 =
=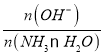 ,则
,则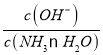 将随水量的增加而增大;
将随水量的增加而增大;
(3) Fe3+沉淀完全时溶液的pH为3.2、Al3+沉淀完全时溶液的pH为5,而Zn2+开始沉淀时的pH为5.9,则欲除去Fe3+、Al3+,调节溶液的pH范围为5~5.9。