题目内容
【题目】支撑海港码头基础的钢管桩,常用外加电流的阴极保护法进行防腐,工作原理如图所示,下列有关表述错误的是

A.利用了电解原理
B.钢管桩上有刺激性气味气体生成
C.电子由电源负极流向钢管桩
D.高硅铸铁作阳极
【答案】B
【解析】
外加电流阴极保护是通过外加直流电源以及辅助阳极,被保护金属与电源的负极相连作为阴极,电子从电源负极流出,给被保护的金属补充大量的电子,使被保护金属整体处于电子过剩的状态,让被保护金属结构电位低于周围环境,从而使得金属腐蚀发生的电子迁移得到抑制,避免或减弱腐蚀的发生,阳极若是惰性电极,则是电解质溶液中的离子在阳极失电子。
A. 由于此保护装置有外加电源,构成了电解池,故利用了电解原理,A正确;
B. 钢管桩要被保护,应做阴极,阴极产生氢气,氢气为无色无味的气体,B错误;
C. 在电解池中,钢管桩要被保护,应做阴极,连接电源的负极,故电子由电源的负极流向钢管桩, C正确;
D. 高硅铸铁连接电源的正极,做电解池的阳极, D正确。
答案选B。

【题目】三硫代碳酸钠(Na2CS3)常用作杀菌剂、沉淀剂。某小组设计实验探究三硫代碳酸钠的性质并测定其溶液的浓度。
实验1:探究Na2CS3的性质
步骤 | 操作及现象 |
① | 取少量Na2CS3 固体溶于蒸馏水配制成溶液并分成两等份 |
② | 向其中一份溶液中滴加几滴酚酞试液,溶液变红色 |
③ | 向另一份溶液中滴加酸性KMnO4溶液,紫色褪去 |
(1)H2CS3是________酸(填“强”或“弱”)。
(2)已知步骤③的氧化产物是SO42-,写出该反应的离子方程式________________________。
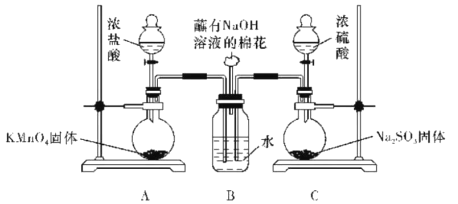
实验2:测定Na2CS3溶液的浓度,按如图所示连接好装置,取100mLNa2CS3溶液置于三颈烧瓶中,打开仪器d的活塞,滴入足量2.0mol/L稀H2SO4,关闭活塞。

已知:Na2CS3 + H2SO4=Na2SO4 + CS2 + H2S↑。CS2和H2S均有毒。CS2不溶于水,沸点46℃,与CO2某些性质相似,与NaOH作用生成Na2COS2和H2O。
(3)盛放无水CaCl2的仪器的名称是____________。
(4)反应结束后打开活塞k,再缓慢通入热N2一段时间,其目的是___________________。
(5)为了计算Na2CS3溶液的浓度,对B中混合物进行过滤、洗涤、干燥、称重,得19.2g固体,则A中Na2CS3的物质的量浓度为____________________。
(6)分析上述实验方案,还可以通过测定C中溶液质量的增加值来计算Na2CS3溶液的浓度,若反应结束后将通热N2改为通热空气,计算值________(填“偏高”、“偏低”或“无影响”)。
【题目】I、300℃时,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应:X(g)+Y(g)2Z(g)ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
(1)反应0~2minZ的平均速率v(Z)=____
(2)能判断该反应已经达到平衡状态的是____
A.生成X的速率是生成Z的速率的2倍 B.容器内压强保持不变
C.容器内气体的密度保持不变 D.容器内各气体的浓度保持不变
(3)温度为300℃时,该反应的化学平衡常数K= ___
II、(1)常温下,0.005mol·L-1Ba(OH)2溶液的pH=_____
(2)常温下,向0.1mol·L-1NH3·H2O溶液中不断加水,过程中c(OH-)/c(NH3·H2O)将____(选填“增大”、“减小”或“不变”)
(3)下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)
Fe3+ | Al3+ | Zn2+ | |
开始沉淀的pH | 1.1 | 3.2 | 5.9 |
完全沉淀的pH | 3.2 | 5 | 8.9 |
某溶液中含Fe3+、Al3+、Zn2+,欲除去Fe3+、Al3+,向其中滴加1.0moL·L-1的NaOH溶液调节溶液的pH为___。