题目内容
【题目】按要求回答下列问题:
(1)甲基的电子式为________,0.5 mol甲基中含有_____mol电子。
(2)丙烷的结构简式为________,该物质常温下为______(填“气态”“液态”或“固态”)。
(3)分子中含30个氢原子的烷烃的分子式为________。
【答案】![]() 4.5 CH3CH2CH3 气态 C14H30
4.5 CH3CH2CH3 气态 C14H30
【解析】
(1)甲基是甲烷分子去一个氢原子得到的原子团,据此回答;
(2)丙烷是气体,分子式为C3H8,据此回答;
(3)烷烃的通式为CnH2n+2,据此回答。
(1) 甲基是甲烷分子去一个氢原子得到的原子团,电子式为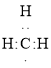 , 0.5 mol甲基中含有0.5 mol×9=4.5mol电子;
, 0.5 mol甲基中含有0.5 mol×9=4.5mol电子;
答案为: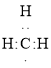 ; 4.5 ;
; 4.5 ;
(2)丙烷的C3H8,则结构简式为CH3CH2CH3,分子内碳原子在1到4的烃在常温下为气态,丙烷室温下呈气态;
答案为:CH3CH2CH3;气态;
(3)烷烃的通式为CnH2n+2,分子中含30个氢原子,则n=14,则烷烃的分子式为C14H30;
答案为:C14H30。

【题目】I、300℃时,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应:X(g)+Y(g)2Z(g)ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
(1)反应0~2minZ的平均速率v(Z)=____
(2)能判断该反应已经达到平衡状态的是____
A.生成X的速率是生成Z的速率的2倍 B.容器内压强保持不变
C.容器内气体的密度保持不变 D.容器内各气体的浓度保持不变
(3)温度为300℃时,该反应的化学平衡常数K= ___
II、(1)常温下,0.005mol·L-1Ba(OH)2溶液的pH=_____
(2)常温下,向0.1mol·L-1NH3·H2O溶液中不断加水,过程中c(OH-)/c(NH3·H2O)将____(选填“增大”、“减小”或“不变”)
(3)下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)
Fe3+ | Al3+ | Zn2+ | |
开始沉淀的pH | 1.1 | 3.2 | 5.9 |
完全沉淀的pH | 3.2 | 5 | 8.9 |
某溶液中含Fe3+、Al3+、Zn2+,欲除去Fe3+、Al3+,向其中滴加1.0moL·L-1的NaOH溶液调节溶液的pH为___。