题目内容
【题目】铅的单质、氧化物、盐在现代工业中有着重要用途。
(1)铅能形成多种氧化物,如碱性氧化物PbO、酸性氧化物PbO2、类似Fe3O4的Pb3O4,盛有PbO2的圆底烧瓶中滴加浓盐酸,产生黄绿色气体,其反应的化学方程式为_______。
(2)以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)和H2SO4为原料,制备高纯PbO,实现铅的再生利用。其工作流程如下:
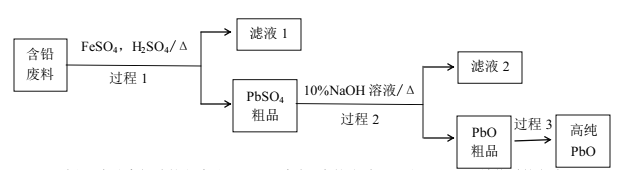
过程1中分离提纯的方法是___,滤液2中的溶质主要是____填物质的名称)。过程1中,在Fe2+催化下,Pb和PbO2反应生成PbSO4的化学方程式是_______。
(3)将PbO溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl4的电解液,电解Na2PbCl4溶液生成Pb的装置如图所示。
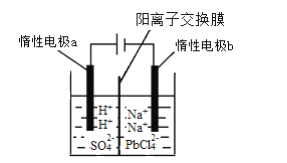
①写出电解时阴极的电极反应式_________。
②电解过程中通过阳离子交换膜的离子主要为____。
③电解过程中,Na2PbCl4电解液浓度不断减小,为了恢复其浓度,应该向____极室(填“阴”或者“阳”)加入____(填化学式)。
【答案】PbO2+4HCl (浓)= PbCl2+Cl2↑+4H2O 过滤 硫酸钠 Pb+ PbO2+2H2SO4 ![]() 2PbSO4+2H2O PbCl42-+2e-=Pb+4Cl- H+ 阴 PbO
2PbSO4+2H2O PbCl42-+2e-=Pb+4Cl- H+ 阴 PbO
【解析】
(1)依据给定信息结合氧化还原反应规律和元素守恒规律作答;
(2)含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)与硫酸亚铁和硫酸作用,生成不溶物PbSO4、炭黑和滤液硫酸铁、硫酸等,其中硫酸亚铁作催化剂,加快Pb和PbO2的反应,经过过滤得到的PbSO4粗品再与氢氧化钠反应制得PbO粗品,再经过分离提纯得到高纯PbO,据此分析作答;
(3)在上述装置图中,电解池的阳极水中的氢氧根离子发生氧化反应生成氧气,阴极则为PbCl42-得电子生成Pb的过程,再结合电解池的原理分析作答。
(1)盛有PbO2的圆底烧瓶中滴加浓盐酸,产生黄绿色气体,则该气体为氯气,根据氧化还原反应的规律及元素守恒可知,产物还有PbCl2和水,其化学方程式为:PbO2+4HCl (浓)= PbCl2+Cl2↑+4H2O;
(2)过程1中得到了滤液和不溶物PbSO4,则过程1的操作方法为过滤;PbSO4与氢氧化钠反应生成物除了PbO以外,应还有硫酸钠,则滤液2中的溶质主要是硫酸钠,在Fe2+催化下,Pb和PbO2在稀硫酸作用下发生归中反应生成PbSO4的方程式为:Pb+ PbO2+2H2SO4 ![]() 2PbSO4+2H2O,故答案为:过滤;硫酸钠;Pb+ PbO2+2H2SO4
2PbSO4+2H2O,故答案为:过滤;硫酸钠;Pb+ PbO2+2H2SO4 ![]() 2PbSO4+2H2O;
2PbSO4+2H2O;
(3)①电解时阴极PbCl42-得电子生成Pb,其电极反应式为PbCl42-+2e-=Pb+4Cl-;
②电解过程中,惰性电极a(阳极)上水失电子发生氧化反应,其电解反应式为:2H2O-4e-=O2↑+4H+,为平衡电荷,生成的H+会通过阳离子交换膜移向阴极,故答案为:H+;
③电解过程中,阴极发生电极反应:PbCl42-+2e-=Pb+4Cl-,则可在阴极补充PbO生成PbCl42-,使Na2PbCl4电解液浓度恢复,故答案为:阴极,PbO。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】天然气是一种清洁能源和重要化工原料。
(1)下列事实能说明CH4分子呈正四面体结构的是___(填字母)。
A.CH4分子的4个C—H共价键键长相等
B.CH4分子中每个键角都是109°28′
C.CH2F2没有同分异构体
D.CCl4的沸点高于CH4的
(2)甲烷与下列烃的通式相同的是___(填字母)。

(3)已知断裂几种化学键要吸收的能量如下:
化学键 | C—H | O=O | C=O | H—O |
断裂1mol键吸收的能量/kJ | 415 | 497 | 745 | 463 |
16gCH4在O2中完全燃烧生成气态CO2和气态水时___(填吸收”或放出”)约___ kJ热量。
(4)天然气/空气燃料电池中,若KOH为电解质,负极反应式为___。等质量的甲烷分别以稀硫酸、KOH溶液为电解质溶液完全放电时,理论上提供的电能之比为___。
【题目】盐酸和氢氧化钠是工业上重要的化工原料,也是实验室里常见的试剂.
Ⅰ.测定中和热.
写出稀盐酸和稀氢氧化钠溶液反应表示中和热的热化学方程式__________________________
(中和热数值为57.3kJ/mol):
(2)取50mL 0.5mol/L HCl溶液与50mL0.55mol/L NaOH溶液进行测定,但实验数值小于57.3kJ/mol,原因不可能是_______________(填序号).
A.用温度计测定NaOH溶液起始温度后直接测定盐酸的温度
B.量取盐酸的体积时仰视读数
C.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
D.实验装置保温、隔热效果差
Ⅱ.酸碱中和滴定.
欲测定某NaOH溶液的物质的量浓度,可用0.1000 mol·L-1 HCl标准溶液进行中和滴定(用酚酞作指示剂)。请回答下列问题:
(1)若甲学生在实验过程中,记录滴定前滴定管内液面读数为1.10 mL,滴定后液面如图,则此时消耗标准溶液的体积为_________________。

(2)乙学生做了三组平行实验,数据记录如下:
实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol·L-1HCl溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.00 | 26.11 |
2 | 25.00 | 1.56 | 31.30 |
3 | 25.00 | 0.22 | 26.31 |
选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为________________(小数点后保留四位)。
(3)下列哪些操作会使测定结果偏高___________(填序号)。
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数
滴定终点的判断__________________________