题目内容
【题目】亚铁氰化钾(K4[Fe(CN)6])双称黄血盐,是一种重要的化工原料。检验三价铁发生的反应为:K4[Fe(CN)6]+FeCl3=KFe[Fe(CN)6]↓(滕氏蓝) +3KCl,回答问题:
(1)写出基态Fe3+的核外电子排布式_________。
(2)K4[Fe(CN)6]中的作用力除共价键外,还有______和________。含有12mol σ键的K4[Fe(CN)6的物质的量为________mol。
(3)黄血盐中N原子的杂化方式为______;C、N、O的第一电离能由大到小的排序为_____,电负性由大到小的排序为________。
(4)Fe、Na、K的晶体结构如图所示:
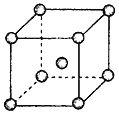
① 钠的熔点比钾更高,原因是__________________________。
② Fe原子半径是r cm,阿伏加德罗常数为NA,铁的相对原子质量为a,则铁单质的密度是_______g/cm3。
【答案】1s22s22p63s23p63d5 或[Ar]3d5 配位键 离子键 1 sp N>O>C O>N>C Na的半径小,形成的金属键键能大,熔点高 ![]()
【解析】
(1)基态Fe3+的核外电子排布式,就是按电子进入轨道的顺序,从能量最低的1s轨道排起,共排布23个电子;
(2)K4[Fe(CN)6]中的作用力除共价键外,还有K+与[Fe(CN)6]4-间的作用力和Fe2+与CN-间的作用力;1个[Fe(CN)6]4-内共含12个σ键,由此可确定含有12molσ键的K4[Fe(CN)6的物质的量;
(3)黄血盐中N原子与C原子间形成共价三键,另外N原子的最外层还有1对孤对电子,从而得出N的杂化方式;C、N、O的第一电离能中,N原子最外层处于半满状态,出现反常;电负性与非金属性成正比;
(4)①钠的熔点比钾更高,原因从离子带电荷与离子半径综合分析;
②由图中可知,1个Fe晶胞中含有2个Fe原子。设晶胞的边长为x,则
4r=![]() ,x=
,x=![]() ,
,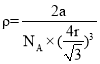 。
。
(1)基态Fe3+的核外电子排布式为1s22s22p63s23p63d5 或[Ar]3d5;
(2)K4[Fe(CN)6]中的作用力除共价键外,还有K+与[Fe(CN)6]4-间的离子键和Fe2+与CN-间的配位键;1个[Fe(CN)6]4-内共含12个σ键,由此可确定含有12molσ键的K4[Fe(CN)6的物质的量为1mol;
(3)黄血盐中N原子与C原子间形成共价三键,另外N原子的最外层还有1对孤对电子,从而得出N的杂化方式sp;C、N、O的第一电离能中,N原子最外层处于半满状态,出现反常,即为N>O>C;电负性与非金属性成正比,即为O>N>C;
(4)①钠的熔点比钾更高,原因是Na的半径小,形成的金属键键能大,熔点高;
②由图中可知,1个Fe晶胞中含有2个Fe原子,设晶胞的边长为x,则
4r=![]() ,x=
,x=![]() ,
,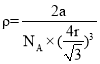 =
=![]() g/cm3。
g/cm3。