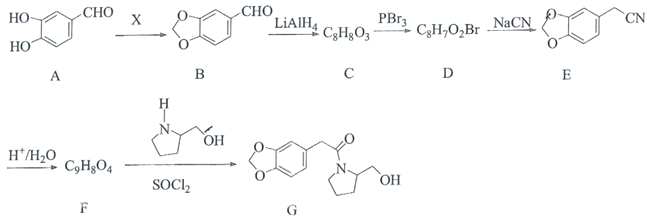
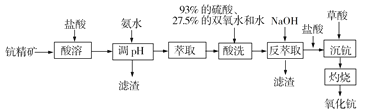
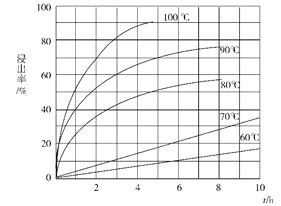
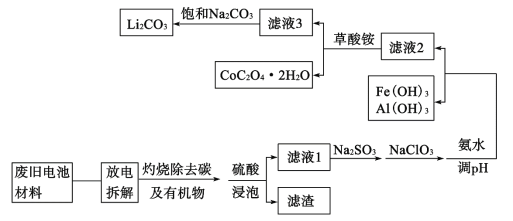
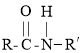题目内容
【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中的相对位置如图所示。若Z原子的最外层电子数是第一层电子数的3倍,下列说法中正确的是( )

A.X的最常见气态氢化物的水溶液显酸性
B.Z的单质与氢气反应比Y单质与氢气反应剧烈
C.最高价氧化物对应水化物的酸性W比Z强
D.X的原子半径小于Y
【答案】C
【解析】
若Z原子的最外层电子数是第一层电子数的3倍,则Z的最外层电子数为6,Z为硫(S);由图中元素的相对位置,可确定W为氯(Cl),Y为氧(O),X为氮(N),据此分析解答。
A.X(N)的最常见气态氢化物的水溶液为氨水,显碱性,A选项错误;
B.非金属性S<O,则Z(S)的单质与氢气反应没有Y(O)单质与氢气反应剧烈,B选项错误;
C.Cl和S为同周期元素,Cl在S的右边,所以非金属性Cl>S,从而得出最高价氧化物对应水化物的酸性W(Cl)比Z(S)强,C选项正确;
D.同周期元素,从左往右,原子半径依次减小,N在O的左边,所以X(N)的原子半径大于Y(O),D选项错误;
答案选C。

【题目】下表是元素周期表的一部分,请用化学用语回答有关问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
1 | ① | |||||||
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ |
(1)⑥的氢氧化物中,所含化学键的类型是______。
(2)①和④可形成化合物,用电子式表示其形成过程______。
(3)⑦的最高价氧化物的水化物与⑧的最高价氧化物的水化物反应的离子方程式为_____。
(4)研究物质的性质差异性是学习的重要方法之一。②、③、⑧、⑨四种元素的最高价氧化物的水化物中,化学性质明显不同于其它三种酸的是______。
(5)能说明元素⑤的非金属性强于元素⑨的非金属性的实验事实是_____(填字母)。
A.两种单质的熔沸点不同
B.两种单质与氢气化合的难易程度
C.比较这两种元素的最高价氧化物的水化物的酸性