题目内容
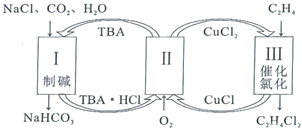
【题目】随着钴酸锂电池的普及使用,从废旧的钴酸锂电池中提取锂、钴等金属材料意义重大。如图是废旧钻酸锂(LiCoO2)(含少量铁、铝、铜等元素的化合物)回收工艺流程:
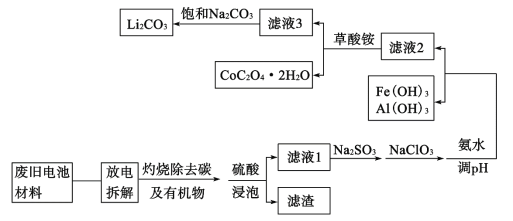
(1)“拆解”前需进入“放电”处理的目的是__;用食盐水浸泡是放电的常用方法,浸泡放电过程中产生的气体主要有__。
(2)上述流程中将CoO2-转化为Co3+的离子方程式为__。
(3)滤液1中加入Na2SO3的主要目的是__;加入NaClO3的主要目的是__。
(4)“沉钴”过程中,(NH4)2C2O4的加入量(图a)、沉淀反应的温度(图b)与钴的沉淀率关系如图所示:

根据图沉钴时应控制n(C2O42-):n(Co2+)比为__,温度控制在__℃左右。
【答案】防止在电池拆解过程中发生短路引起火灾及操作人员触电 H2、Cl2 4H++CoO2-=2H2O+Co3+ 将Co3++还原为Co2+ 将Fe2+氧化为Fe3+ 1.15 46
【解析】
由题给流程图可知,废旧的钴酸锂电池放电拆解后,通过灼烧除去碳和有机物后,用硫酸浸泡剩余物,CoO2-与硫酸反应转化为Co3+离子,铁和铝元素的化合物溶于硫酸生成硫酸亚铁和硫酸铝,铜元素的化合物不溶于硫酸进入滤渣中;过滤后,向滤液1中先加入Na2SO3,将Co3+还原为Co2+,再加入NaClO3将Fe2+氧化为Fe3+,最后加入氨水调节溶液pH,使Fe3+和Al3+转换为氢氧化铁和氢氧化铝沉淀;过滤后,向滤液2中加入草酸铵,使Co2+转化为CoC2O42H2O沉淀;过滤后,向滤液3中加入饱和碳酸钠溶液,使Li+转化为Li2CO3沉淀。
(1)电池在拆解过程中容易发生短路引起火灾或导致操作人员触电,则拆解前必须进行放电处理;用食盐水浸泡放电过程实际是电解食盐水的过程,电解时,氯离子在阳极失去电子发生氧化反应生成氯气,水电离出的氢离子在阴极得到电子发生还原反应生成氢气,故答案为:电池拆解过程中发生短路引起火灾及操作人员触电;H2、Cl2;
(2)用硫酸浸泡时,CoO2—与H+反应转化为Co3+离子和水,反应的离子方程式为4H++CoO2—=2H2O+Co3+,故答案为:4H++CoO2—=2H2O+Co3+;
(3)Co3+具有氧化性,向滤液1中加入具有还原性的Na2SO3,能将Co3+还原为Co2+;亚铁离子具有还原性,加入具有氧化性的NaClO3,能将Fe2+氧化为Fe3+,便于调节pH时,将Fe3+ +转换为氢氧化铁沉淀,故答案为:将Co3++还原为Co2+;将Fe2+氧化为Fe3+;
(4)由左图可知,n(C2O42-):n(Co2+)比为1.15时,钴的沉淀率最大,效果最好;由右图可知,沉淀反应温度为46℃左右时,钴的沉淀率最大,效果最好,故答案为:1.15;46。

 阅读快车系列答案
阅读快车系列答案【题目】为研究铁盐与亚硫酸盐之间的反应,某研究小组利用孔穴板进行了实验探究:

小组记最的实验现象如下表所示:
开始时 | 5min 后 | 3天后 | |
实验I | 溶液立即变为红褐色,比II、III中略浅 | 与开始混合时一致 | 溶液呈黄色,底部出现红褐色沉淀 |
实验II | 溶液立即变为红褐色 | 红褐色明显变浅 | 溶液呈黄绿色 |
实验III | 溶液立即变为红褐色 | 红褐色变浅,比II中深 | 溶液呈黄色 |
(1)测得实验所用0.4mol/LFeCl3溶液及Fe(NO3)3溶液pH均约为1.0。两溶液均呈酸性的原因是_______________(用离子方程式表示)。
(2)开始混合时,实验I中红褐色比II、III中略浅的原因是____________________________。
(3)为了探究5min后实验II、III中溶液红褐色变浅的原因,小组同学设计了实验IV;分别取少量 5min后实验I、II、III中溶液,加入2滴铁氰化钾溶液,发现实验II、III中出现蓝色沉淀,实验I中无明显变化。试用方程式解释溶液中出现Fe2+的原因______________________________。
(4)针对5min后实验III中溶液颜色比实验II中深,小组同学认为可能存在三种因素:
①Cl-可以加快Fe3+与SO32-的氧化还原反应:
②NO3-可以______________________________;
③NO3-在酸性环境下代替Fe3+氧化了SO32-,同时消耗H+,使Fe3+水解出的Fe(OH)3较多。
通过实验V和实验VI进行因素探究:
实验操作(己知Na+对实验无影响) | 5min后的现象 | |
实验V | 在2mLpH=1.0的0.4mol/L Fe(NO3)3溶液中溶解 固体,再加入2滴0.4mol/L Na2SO3溶液 | 溶液的红褐色介于II、III之间 |
实验VI | 在2mLpH=1.0的稀硝酸中溶解约0.19gNaNO3固体,再加 入2滴0.4mol/LNa2SO3溶液。向其中滴入少量BaCl2溶液 | _______________________。 |
实验结论:因素①和因素②均成立,因素③不明显。请将上述方案填写完整。
(5)通过上述时间,以下结果或推论合理的是_______________(填字母)。
a.Fe3+与SO32-同时发生水解反应和氧化还原反应,且水解反应的速率快,等待足够长时间后,将以氧化还原反应为主
b.浓度为1.2mol/L的稀硝酸在5min内不能将Fe2+氧化
c.向pH大于1的稀硝酸中加入少量Ba(NO3)2,使其完全溶解,可用来检验实验1的上层淸液中是否存在SO42-