题目内容
【题目】氧化钪(Sc2O3)在合金、电光源、催化剂、激活剂和陶瓷等领域有广泛的应用,利用钪精矿为原料(主要成分为Sc2O3,还含有Fe2O3、MnO等杂质)生产氧化钪的一种工艺流程如下:

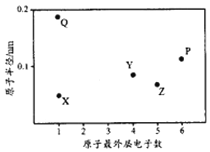
(1)“酸溶”步骤中,钪的浸出率结果如图所示。由图可知,为使钪的浸出率达90%左右,所采用的生产条件为___________________。

(2)加入氨水调节pH=3,过滤,滤渣主要成分是_____________;若再向滤液加入氨水调节pH=6,滤液中 Sc3+能否沉淀完全(离子浓度小于105 mol/L)?______________(列式计算并作判断)。(25℃时,Ksp[Mn(OH)2]=1.9×1013、Ksp[Fe(OH)3]=2.6×1039,Ksp[Sc(OH)3]=9.0×1031)
(3)已知钪与铝类似,其氢氧化物具有两性。反萃取步骤中,加入NaOH使溶液呈碱性,碱性条件下双氧水可以氧化锰离子生成滤渣,写出该反应的离子方程式______________。
(4)“沉钪”前先加入稀盐酸调节溶液至酸性,然后用草酸“沉钪”。25℃时pH=2的草酸溶液中![]() =_________________________。写出“沉钪”得到草酸钪(难溶于稀酸)的离子方程式___________________[25℃时,草酸电离平衡常数为Ka1=5.0×102,Ka2=5.4×105]。
=_________________________。写出“沉钪”得到草酸钪(难溶于稀酸)的离子方程式___________________[25℃时,草酸电离平衡常数为Ka1=5.0×102,Ka2=5.4×105]。
(5)草酸钪“灼烧”的化学方程式为_______________________。
【答案】100℃、4.5 h Fe(OH)3 c(Sc3+)=Ksp[Sc(OH)3]/c3(OH)=9.0×107mol·L<1×105 mol/L,故已沉淀完全 Mn2++H2O2+2OH![]() MnO2↓+2H2O 2.7×102 2Sc3++ 3H2C2O4
MnO2↓+2H2O 2.7×102 2Sc3++ 3H2C2O4![]() Sc2(C2O4)3↓+ 6H+ 2Sc2(C2O4)3+3O2
Sc2(C2O4)3↓+ 6H+ 2Sc2(C2O4)3+3O2![]() 2Sc2O3+12CO2
2Sc2O3+12CO2
【解析】
(1)由图可知,当钪的浸出率为90%时,所采用的生产条件为100℃、4.5 h。
(2)根据Ksp[Mn(OH)2]=1.9×1013、Ksp[Fe(OH)3]=2.6×1039,Ksp[Sc(OH)3]=9.0×1031,pH=3时,计算三种金属离子的浓度分别为:c(Mn2+)=1.9×109 mol/L,c(Fe3+)=2.6×106 mol/L,c(Sc3+)=9.0×102 mol/L,c(Fe3+)<105 mol/L,Fe3+完全沉淀,因此加入氨水调节pH=3,过滤,滤渣的主要成分是Fe(OH)3。再向滤液中加入氨水调节pH=6,c(OH)=1×108 mol/L,c(Sc3+)=Ksp[Sc(OH)3]/c3(OH)=9.0×107 mol/L <1×105 mol/L,故已沉淀完全。
(3)碱性条件下,双氧水氧化锰离子生成滤渣,锰的化合价升高,应生成不难溶的MnO2,由此可写出离子方程式:Mn2++H2O2+2OH![]() MnO2↓+2H2O。
MnO2↓+2H2O。
(4)25℃时pH=2的草酸溶液中![]() =
=![]() ×
×![]() ×
×![]() ×
×![]() =Ka1×Ka2×
=Ka1×Ka2×
![]() =2.7×102,“沉钪”得到草酸钪的离子方程式为:2Sc3++3H2C2O4
=2.7×102,“沉钪”得到草酸钪的离子方程式为:2Sc3++3H2C2O4![]() Sc2(C2O4)3↓+6H+。
Sc2(C2O4)3↓+6H+。
(5)草酸钪“灼烧”氧化是草酸钪和氧气反应生成氧化钪和二氧化碳,反应的化学方程式为2Sc2(C2O4)3+3O2![]() 2Sc2O3+12CO2。
2Sc2O3+12CO2。

【题目】探究铁在某浓度H3PO4和H2O2的混合溶液中反应的情况,进行如下实验:
实验 | 操作 | 现象 |
Ⅰ | 将除去氧化膜的铁钉置于烧杯中,加入30mL1.0molL-1H3PO4和3mL30%H2O2的混合溶液(pH≈1)。 | 一段时间后铁钉表面突然产生大量气泡,随后停止产生气泡;一段时间后再产生大量气泡,再停止,出现周而往复的现象。过程中,溶液保持澄清。
|
Ⅱ | 将与实验Ⅰ相同的铁钉放入烧杯中,加入30mL1.0molL-1H3PO4和3mLH2O。 | 片刻后铁钉表面持续产生气泡,溶液保持澄清。 |
已知:Fe3(PO4)2难溶于水,Fe(H2PO4)2溶于水。
(1)用85%H3PO4配制100mL1.0mol·L-1H3PO4所用的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管、______。
(2)请结合实验Ⅱ中现象,分析铁钉与H3PO4反应的产物_______。
(3)探究实验Ⅰ中停止产生气泡的原因。
提出假设:铁钉表面形成了含有+3价铁的氧化膜将铁钉覆盖。甲同学进行实验Ⅲ,得出假设成立的结论。
实验Ⅲ:将洗净的实验Ⅰ中无气泡产生时的铁钉置于试管中,加入滴有KSCN溶液的稀H2SO4,振荡,静置,溶液呈红色。
乙同学认为实验Ⅲ无法证实假设成立,其理由是未排除O2的干扰,请解释O2是如何干扰实验的:_____。
乙同学通过改进实验证实了假设成立。
(4)铁钉表面突然产生大量气泡的可能原因是Fe2+迅速被H2O2氧化形成氧化膜,使聚集在铁钉表面的H2脱离铁钉表面。形成氧化膜(以Fe3O4计)的离子方程式是____。
(5)实验Ⅰ中周而往复的现象与铁钉表面氧化膜的生成和溶解密切相关,从反应的速率角度分析其原因:______。
【题目】用下列装置能达到实验目的的是
A |
| 淸洗铜与浓硫 酸反应后有残 液的试管 | B |
| 配置一定物质的量浓度的溶液实验中,为定容时的操作 |
C |
| 以淀粉为指示 剂,用酸式滴 定管盛放 Na2S2O3标准溶液进行滴定 | D |
| 装置为制备并用 排气法收集NO 气体的装置(稀硝酸+钢屑) |
A. AB. BC. CD. D