题目内容
【题目】水合肼(N2H4·H2O)又名水合联氨,无色透明,是具有腐蚀性和强还原性的碱性液体,它是一种重要的化工试剂。利用尿素法生产水合肼的原理为:CO(NH2)2+2NaOH+NaClO=N2H4·H2O+Na2CO3+NaCl。
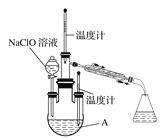
实验1:制备NaClO溶液。(已知:3NaClO![]() 2NaCl+NaClO3)
2NaCl+NaClO3)
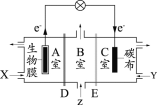
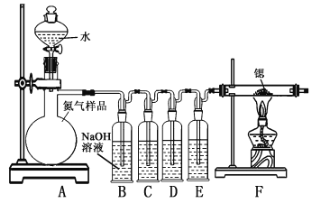
(1)如图装置Ⅰ中烧瓶内发生反应的化学方程式为___________。

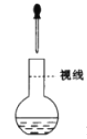
(2)用NaOH固体配制溶质质量分数为30%的NaOH溶液时,所需玻璃仪器除量筒外还有__________(填字母)。
a.烧杯 b.容量瓶 c.玻璃棒 d.烧瓶
(3)图中装置Ⅱ中用冰水浴控制温度的目的是__________ 。
实验2:制取水合肼。
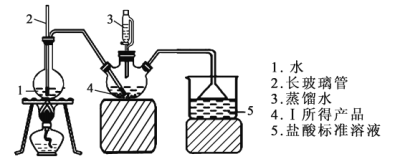
(4)图中充分反应后,____________(填操作名称)A中溶液即可得到水合肼的粗产品。若分液漏斗滴液速度过快,部分N2H4·H2O会参与A中反应并产生大量氮气,降低产品产率。写出该过程反应生成氮气的化学方程式 ________。
实验3:测定馏分中水合肼的含量。
(5)称取馏分3.0g,加入适量NaHCO3固体(滴定过程中,调节溶液的pH保持在6.5左右),加水配成250 mL溶液,移出25.00 mL置于锥形瓶中,并滴加2~3滴淀粉溶液,用0.15 mol·L-1的碘的标准溶液滴定(已知:N2H4·H2O+2I2=N2↑+4HI+H2O)。
①滴定时,碘的标准溶液盛放在 ________(填“酸式”或“碱式”)滴定管中。
②下列能导致馏分中水合肼的含量测定结果偏高的是 _________(填字母)。
a.锥形瓶清洗干净后未干燥 b.滴定前,滴定管内无气泡,滴定后有气泡
c.读数时,滴定前平视,滴定后俯视 d.盛标准液的滴定管水洗后,直接装标准液
③实验测得消耗I2溶液的平均值为20.00mL,馏分中水合肼(N2H4·H2O)的质量分数为 _________。
【答案】MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O a c 防止NaClO受热分解,影响水合肼的产率 蒸馏 N2H4·H2O+2NaClO=N2↑+3H2O+2NaCl 酸式 d 25%
MnCl2+Cl2↑+2H2O a c 防止NaClO受热分解,影响水合肼的产率 蒸馏 N2H4·H2O+2NaClO=N2↑+3H2O+2NaCl 酸式 d 25%
【解析】
(1)装置Ⅰ中烧瓶内浓盐酸与二氧化锰共热反应生成氯化锰、氯气和水;
(2)配制30%NaOH溶液时,用天平称量一定质量的氢氧化钠固体,在烧杯中加水溶解,并用玻璃棒搅拌;
(3)由题给信息可知,次氯酸钠受热易分解生成氯化钠和氯酸钠,降温可以防止NaClO受热分解;
(4)N2H4H2O具有强还原性,若分液漏斗滴液速度过快,部分N2H4·H2O与次氯酸钠反应;
(5)①碘的标准溶液具有氧化性,可以腐蚀橡皮管;
②依据操作不当对标准溶液体积的 影响分析解答;
③由方程式N2H4·H2O+2I2=N2↑+4HI+H2O可得如下关系N2H4·H2O—2I2,由此计算N2H4·H2O的物质的量和质量分数。
(1)装置Ⅰ中烧瓶内浓盐酸与二氧化锰共热反应生成氯化锰、氯气和水,反应的化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2)配制30%NaOH溶液时,用天平称量一定质量的氢氧化钠固体,在烧杯中加水溶解,并用玻璃棒搅拌,需要玻璃仪器有烧杯、玻璃棒,故答案为:ac;
(3)由题给信息可知,次氯酸钠受热易分解生成氯化钠和氯酸钠,图中装置Ⅱ中用冰水浴控制温度可以防止NaClO受热分解,影响水合肼的产率,故答案为:防止NaClO受热分解,影响水合肼的产率;
(4)由反应方程式示可知,加热蒸馏三颈烧瓶内的溶液可得到水合肼的粗产品;N2H4H2O具有强还原性,若分液漏斗滴液速度过快,部分N2H4·H2O与次氯酸钠反应生成氮气、氯化钠和水,反应的化学方程式为N2H4H2O+2NaClO=N2↑+3H2O+2NaCl,故答案为:蒸馏;N2H4H2O+2NaClO=N2↑+3H2O+2NaCl;
(5)①碘的标准溶液具有氧化性,可以腐蚀橡皮管,应盛放在酸式滴定管中,故答案为:酸式;
②a.锥形瓶清洗干净后未干燥,不影响水合肼的物质的量,对实验结果无影响,故错误;
b.滴定前,滴定管内无气泡,滴定后有气泡会导致碘的标准溶液体积偏小,所测结果偏小,故错误;
c.读数时,滴定前平视,滴定后俯视会导致碘的标准溶液体积偏小,所测结果偏小,故错误;
d.盛标准液的滴定管水洗后,直接装标准液会稀释碘的标准溶液,导致碘的标准溶液体积偏大,所测结果偏高,故正确;
d正确,故答案为:d;
③由方程式N2H4·H2O+2I2=N2↑+4HI+H2O可得如下关系N2H4·H2O—2I2,则3.0g馏分中n(N2H4·H2O)=![]() n(I2)×10=
n(I2)×10=![]() ×0.15 mol·L-1×20×10—3L×10=0.015 mol,则馏分中水合肼(N2H4·H2O)的质量分数为
×0.15 mol·L-1×20×10—3L×10=0.015 mol,则馏分中水合肼(N2H4·H2O)的质量分数为![]() ×100%=25%,故答案为:25%。
×100%=25%,故答案为:25%。

 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案【题目】用下列装置能达到实验目的的是
A |
| 淸洗铜与浓硫 酸反应后有残 液的试管 | B |
| 配置一定物质的量浓度的溶液实验中,为定容时的操作 |
C |
| 以淀粉为指示 剂,用酸式滴 定管盛放 Na2S2O3标准溶液进行滴定 | D |
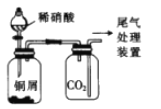
| 装置为制备并用 排气法收集NO 气体的装置(稀硝酸+钢屑) |
A. AB. BC. CD. D
【题目】某小组研究铁与水蒸气的反应,两位同学分别进行了如下实验。
实验Ⅰ | 实验Ⅱ |
|
|
请回答:
(1)实验Ⅰ中湿棉花的作用是______________。
(2)实验Ⅰ中反应的化学方程式是__________。
(3)甲同学观察到实验Ⅰ中持续产生肥皂泡,实验Ⅱ中溶液B呈现红色。说明溶液A中含有___________。
(4)乙同学观察到实验Ⅰ中持续产生肥皂泡,但实验Ⅱ中溶液B未呈现红色。溶液B未呈现红色的原因是____________。
【题目】为研究铁盐与亚硫酸盐之间的反应,某研究小组利用孔穴板进行了实验探究:

小组记最的实验现象如下表所示:
开始时 | 5min 后 | 3天后 | |
实验I | 溶液立即变为红褐色,比II、III中略浅 | 与开始混合时一致 | 溶液呈黄色,底部出现红褐色沉淀 |
实验II | 溶液立即变为红褐色 | 红褐色明显变浅 | 溶液呈黄绿色 |
实验III | 溶液立即变为红褐色 | 红褐色变浅,比II中深 | 溶液呈黄色 |
(1)测得实验所用0.4mol/LFeCl3溶液及Fe(NO3)3溶液pH均约为1.0。两溶液均呈酸性的原因是_______________(用离子方程式表示)。
(2)开始混合时,实验I中红褐色比II、III中略浅的原因是____________________________。
(3)为了探究5min后实验II、III中溶液红褐色变浅的原因,小组同学设计了实验IV;分别取少量 5min后实验I、II、III中溶液,加入2滴铁氰化钾溶液,发现实验II、III中出现蓝色沉淀,实验I中无明显变化。试用方程式解释溶液中出现Fe2+的原因______________________________。
(4)针对5min后实验III中溶液颜色比实验II中深,小组同学认为可能存在三种因素:
①Cl-可以加快Fe3+与SO32-的氧化还原反应:
②NO3-可以______________________________;
③NO3-在酸性环境下代替Fe3+氧化了SO32-,同时消耗H+,使Fe3+水解出的Fe(OH)3较多。
通过实验V和实验VI进行因素探究:
实验操作(己知Na+对实验无影响) | 5min后的现象 | |
实验V | 在2mLpH=1.0的0.4mol/L Fe(NO3)3溶液中溶解 固体,再加入2滴0.4mol/L Na2SO3溶液 | 溶液的红褐色介于II、III之间 |
实验VI | 在2mLpH=1.0的稀硝酸中溶解约0.19gNaNO3固体,再加 入2滴0.4mol/LNa2SO3溶液。向其中滴入少量BaCl2溶液 | _______________________。 |
实验结论:因素①和因素②均成立,因素③不明显。请将上述方案填写完整。
(5)通过上述时间,以下结果或推论合理的是_______________(填字母)。
a.Fe3+与SO32-同时发生水解反应和氧化还原反应,且水解反应的速率快,等待足够长时间后,将以氧化还原反应为主
b.浓度为1.2mol/L的稀硝酸在5min内不能将Fe2+氧化
c.向pH大于1的稀硝酸中加入少量Ba(NO3)2,使其完全溶解,可用来检验实验1的上层淸液中是否存在SO42-