题目内容
【题目】已知水在25 ℃和95 ℃时,其电离平衡曲线如下图所示:
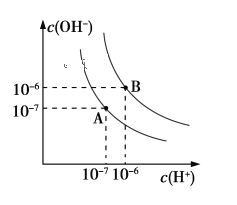
(1)则25 ℃时水的电离平衡曲线应为_______(填“A”或“B”),请说明理由_____________________。
(2)25 ℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若混合溶液的pH=7,则NaOH溶液与pH=4的H2SO4溶液的体积比为________。
(3)95 ℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,a+b=_______________
(4)曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5,则HA为_______(填“强”或“弱”)酸
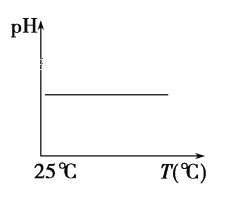
(5)下列溶液pH随温度的变化如图所示的是______(不考虑溶质、溶剂挥发)
a.稀硫酸 b.NaOH溶液 c.NaCl 溶液 d.氨水 e.醋酸
(6)下表室温下为几种弱电解质的电离平衡常数
CH3COOH | H2CO3 | H2S | NH3·H2O |
1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | 1.8×10-5 |
少量CO2与NaHS反应的离子方程式为_________________________________________。室温下,CH3COONH4溶液的pH_________7(填“>”、“<”或“=”)
(7)25 ℃时,如果取0.1 mol·L-1HA溶液与0.1 mol·L-1 NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,原因是___________________________________________(用离子方程式表示)
【答案】A 水的电离是吸热过程,温度低时,电离程度小,c(H+)、c(OH-)小 10︰1 a+b=14 弱 a HS-+H2O+CO2===H2S+HCO3- = A-+H2O ![]() HA+OH-
HA+OH-
【解析】
(1)曲线A对应的水的离子积常数是c(H+)×c(OH-)=10-14,曲线B对应的水的离子积常数是c(H+)×c(OH-)=10-12;
(2) 25 ℃时,pH=7说明硫酸和氢氧化钠恰好完全反应。
(3)根据图示,95 ℃时,水的离子积常数是10-12,强酸、强碱混合后溶液呈中性,则c(H+)×V(酸)=c(OH-) ×V(碱);
(4)曲线B对应的水的离子积常数是10-12,混合溶液的pH=5,呈酸性。
(5)根据图示,升高温度,溶液的pH不变,即氢离子浓度不变。
(6)根据电离平衡常数可知 ,酸性:H2CO3> H2S > HCO3-;CH3COOH和NH3·H2O电离平衡常数相等。
(7)25 ℃时, 0.1 mol·L-1HA溶液与0.1 mol·L-1 NaOH溶液等体积混合,恰好完全反应生成NaA。混合溶液的pH=8,说明NaA是强碱弱酸盐,A-水解。
水的电离是吸热过程,温度低时,电离程度小,c(H+)、c(OH-)均减小,水的离子积常数小,所以25 ℃时水的电离平衡曲线应为A;
(2) 25 ℃时,pH=7说明硫酸和氢氧化钠恰好完全反应,c(H+)×V(酸)=c(OH-) ×V(碱),10-4×V(酸)= 10-5 ×V(碱),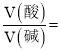
![]() ,NaOH溶液与pH=4的H2SO4溶液的体积比为10:1;
,NaOH溶液与pH=4的H2SO4溶液的体积比为10:1;
(3)根据图示,95 ℃时,水的离子积常数是10-12,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则10-a×100= 10-12+b ×1;a+b=14;
(4)曲线B对应的水的离子积常数是10-12,若HA为强酸,则等体积混合后呈中性,pH=6,实际混合后溶液的pH=5,呈酸性,所以HA为弱酸;
(5) a.稀硫酸是强酸,加热稀硫酸,氢离子浓度不变,故选a;
b.氢氧化钠的强碱,加热NaOH溶液,氢氧根离子浓度不变,水的离子积常数增大,氢离子浓度增大,故不选b;
c.氯化钠是强电解质,溶液呈中性,加热NaCl 溶液,水的离子积常数增大,氢离子、氢氧根离子浓度均增大,故不选c;
d.氨水是弱碱,加热氨水,电离平衡正向移动,氢氧根离子浓度增大,氢离子浓度减小,故不选d;
e.醋酸是弱电解质,加热醋酸,电离平衡正向移动,氢离子浓度增大,故不选e;
故答案选a;
(6)根据电离平衡常数可知 ,酸性:H2CO3> H2S > HCO3-,少量CO2与NaHS反应生成硫化氢和碳酸氢钠,反应的离子方程式为HS-+H2O+CO2===H2S+HCO3-;CH3COOH和NH3·H2O电离平衡常数相等,所以铵根离子、醋酸根离子水解程度相同,室温下,CH3COONH4溶液的pH=7;
(7)25 ℃时,0.1 mol·L-1HA溶液与0.1 mol·L-1 NaOH溶液等体积混合,恰好完全反应生成NaA。混合溶液的pH=8,说明NaA是强碱弱酸盐,A-水解,离子方程式是A-+H2O HA+OH-。

 名师点拨卷系列答案
名师点拨卷系列答案【题目】锌锰干电池是最早使用的化学电池,其基本构造如图1所示.

(1)锌锰干电池的负极电极反应式是 ______ ,电路中每通过0.4mol e-,负极质量减少 ______ g;工作时NH4+离子在正极放电产生2种气体,其中一种气体分子是含10e-的微粒,正极的电极反应式是 ______ 。
(2)某研究小组对电池内黑色糊状物进行了如图2所示实验
已知:Zn(OH)2是两性氢氧化物.完成下列实验报告:
实验步骤 | 实验现象 | 实验结论 |
①取少量上述无色溶液于试管中,逐滴加入NaOH溶液,直至过量。 | 生成白色沉淀, ______ | 无色溶液中 存在Zn2+离子 |
② ______ | ______ | 无色溶液中 存在NH4+离子 |
(3)利用残渣中分离出的MnO2,研究其在H2O2制O2过程中的作用.实验装置如图3所示.将等物质的量浓度、等体积H2O2溶液加入分液漏斗中,分别进行2个实验(气体的体积在相同条件下测定)。
序号 | 烧瓶中的物质 | 实验记录 | 实验结论与解释 |
实验一 | 足量MnO2 | 收集到56mL气体 | MnO2做催化剂 |
实验二 | 足量MnO2 和稀硫酸 | 黑色粉末部分溶解, 收集到112mL气体 | ______ ______ |
①实验一、二中参加反应的H2O2的物质的量之比为 ______ ;
②实验二中反应的离子方程式为 ______ ;
③在测量气体体积时,除要注意待气体温度恢复至室温、平视读数外,还需要注意____ 。
【题目】下列实验中根据现象得出的结论错误的是
选项 | 实验 | 现象 | 结论 |
A | 向 | 先出现白色沉淀,最终沉淀又溶解 | Y可能是 |
B | 向某溶液中加入Cu和浓 | 试管口有红棕色气体产生 | 原溶液可能含有 |
C | 将Na投到一定浓度的 | 出现气泡并有固体生成 | Na与 |
D | 向浓度均为 | 先出现蓝色沉淀 |
|
A.AB.
【题目】通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一。对下列实验事实的解释正确的是
现象 | 解释 | |
A | 用洁净的铂丝蘸取某溶液进行焰色反应,火焰呈黄色 | 该溶液中一定含有 |
B |
|
|
C | 某溶液中先加入稀盐酸无现象,再加入氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有 |
D | 铁加入稀硝酸中有气泡产生 | 铁与稀硝酸发生了置换反应 |
A.AB.BC.CD.D