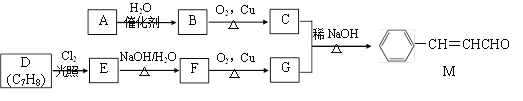
题目内容
【题目】通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一。对下列实验事实的解释正确的是
现象 | 解释 | |
A | 用洁净的铂丝蘸取某溶液进行焰色反应,火焰呈黄色 | 该溶液中一定含有 |
B |
|
|
C | 某溶液中先加入稀盐酸无现象,再加入氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有 |
D | 铁加入稀硝酸中有气泡产生 | 铁与稀硝酸发生了置换反应 |
A.AB.BC.CD.D
【答案】C
【解析】
![]() 观察K的焰色反应需要透过蓝色的钴玻璃,由操作和现象可知,溶液中一定含有
观察K的焰色反应需要透过蓝色的钴玻璃,由操作和现象可知,溶液中一定含有![]() ,不能确定是否含
,不能确定是否含![]() ,故A错误;
,故A错误;
B.氯气与水反应生成HClO具有漂白性,氯气不具有漂白性,故B错误;
C.先加盐酸无现象,排除干扰离子,再加入氯化钡溶液,生成硫酸钡白色沉淀,则溶液中一定含有![]() ,故C正确;
,故C正确;
D.铁加入稀硝酸中发生氧化还原反应生成NO,生成物中无单质,不发生置换反应,故D错误;
故选:C。

 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案【题目】下列实验操作及对应解释或结论正确的是![]()
选项 | 实验操作 | 解释或结论 |
A | 向某溶液中滴加盐酸酸化的 | 原溶液中一定含有 |
B | 将 |
|
C | 用蒸馏水润湿的pH试纸测溶液的pH | 一定会使测定结果偏低 |
D | 向混有乙酸和乙醇的乙酸乙酯中加入氢氧化钠溶液 | 除去溶液中的乙酸和乙醇 |
A.AB.BC.CD.D
【题目】已知水在25 ℃和95 ℃时,其电离平衡曲线如下图所示:
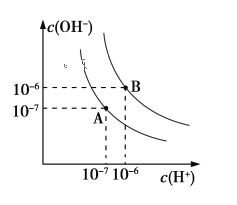
(1)则25 ℃时水的电离平衡曲线应为_______(填“A”或“B”),请说明理由_____________________。
(2)25 ℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若混合溶液的pH=7,则NaOH溶液与pH=4的H2SO4溶液的体积比为________。
(3)95 ℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,a+b=_______________
(4)曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5,则HA为_______(填“强”或“弱”)酸
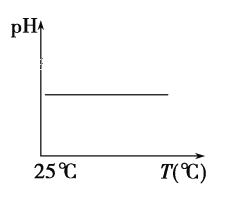
(5)下列溶液pH随温度的变化如图所示的是______(不考虑溶质、溶剂挥发)
a.稀硫酸 b.NaOH溶液 c.NaCl 溶液 d.氨水 e.醋酸
(6)下表室温下为几种弱电解质的电离平衡常数
CH3COOH | H2CO3 | H2S | NH3·H2O |
1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | 1.8×10-5 |
少量CO2与NaHS反应的离子方程式为_________________________________________。室温下,CH3COONH4溶液的pH_________7(填“>”、“<”或“=”)
(7)25 ℃时,如果取0.1 mol·L-1HA溶液与0.1 mol·L-1 NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,原因是___________________________________________(用离子方程式表示)