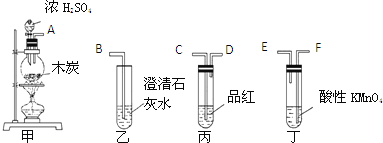
题目内容
【题目】下列说法正确的是
A.某气体能使品红溶液褪色,则该气体是![]()
B.等质量的铜按a,b两种途径完全转化为硝酸铜,途径a,b消耗的硝酸一样多:途径a:Cu![]() CuO
CuO![]() Cu(NO3)2;途径b:Cu
Cu(NO3)2;途径b:Cu![]() Cu(NO3)2;
Cu(NO3)2;
C.向某溶液中加入![]() 溶液,产生白色沉淀,加入稀硝酸沉淀不溶解,则原溶液中不一定有
溶液,产生白色沉淀,加入稀硝酸沉淀不溶解,则原溶液中不一定有![]()
D.向某溶液中加入NaOH并加热,产生可使湿润的蓝色石蕊试纸变红的气体,则原溶液中有![]()
【答案】C
【解析】
![]() 二氧化硫及具有强氧化性的气体均可使品红溶液褪色,则能使品红溶液褪色的气体不一定是
二氧化硫及具有强氧化性的气体均可使品红溶液褪色,则能使品红溶液褪色的气体不一定是![]() ,还可能为氯气等,故A错误;
,还可能为氯气等,故A错误;
B.若均生成![]() ,途径a中消耗
,途径a中消耗![]() ,途径b消耗
,途径b消耗![]() ,则等质量的铜按a,b两种途径完全转化为硝酸铜,途径a,b消耗的硝酸不同,故B错误;
,则等质量的铜按a,b两种途径完全转化为硝酸铜,途径a,b消耗的硝酸不同,故B错误;
C.白色沉淀为硫酸钡,但亚硫酸根离子可被硝酸氧化生成硫酸根离子,则原溶液中不一定有![]() ,故C正确;
,故C正确;
D.氨气使红色石蕊试纸变蓝,则产生可使湿润的蓝色石蕊试纸变红的气体,气体为酸性气体,则不能确定原溶液中是否有![]() ,故D错误;
,故D错误;
故选:C。

 优学名师名题系列答案
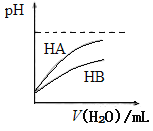
优学名师名题系列答案【题目】已知水在25 ℃和95 ℃时,其电离平衡曲线如下图所示:
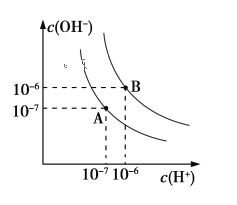
(1)则25 ℃时水的电离平衡曲线应为_______(填“A”或“B”),请说明理由_____________________。
(2)25 ℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若混合溶液的pH=7,则NaOH溶液与pH=4的H2SO4溶液的体积比为________。
(3)95 ℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,a+b=_______________
(4)曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5,则HA为_______(填“强”或“弱”)酸
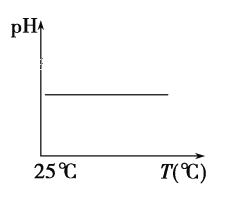
(5)下列溶液pH随温度的变化如图所示的是______(不考虑溶质、溶剂挥发)
a.稀硫酸 b.NaOH溶液 c.NaCl 溶液 d.氨水 e.醋酸
(6)下表室温下为几种弱电解质的电离平衡常数
CH3COOH | H2CO3 | H2S | NH3·H2O |
1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | 1.8×10-5 |
少量CO2与NaHS反应的离子方程式为_________________________________________。室温下,CH3COONH4溶液的pH_________7(填“>”、“<”或“=”)
(7)25 ℃时,如果取0.1 mol·L-1HA溶液与0.1 mol·L-1 NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,原因是___________________________________________(用离子方程式表示)