题目内容
【题目】已知:可逆反应mA(g)+nB(g)pC(g)在密闭容器中进行,下图表示在不同反应时间t时,温度T和压强P与生成物C在混合物中的体积百分含量的关系曲线, 由曲线分析下列判断正确的是( )
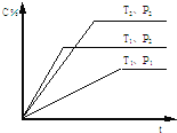
A.T1<T2,P1>P2,m+n>p,正反应吸热
B.T1>T2,P1<P2,m+n>p,正反应放热
C.T1<T2,P1>P2,m+n<p,正反应放热
D.T1>T2,P1<P2,m+n<p,正反应吸热
【答案】B
【解析】
由图象可知,温度为T1时,根据到达平衡的时间可知P2>P1,且压强越大,C的含量高,说明压强增大平衡向正反应方向移动,故正反应为气体体积减小的反应,即m+n>p;压强为P2时,根据到达平衡的时间可知T1>T2,且温度越高,C的含量低,说明温度升高平衡向逆反应方向移动,则正反应为放热反应,故答案为B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下列实验操作及对应解释或结论正确的是![]()
选项 | 实验操作 | 解释或结论 |
A | 向某溶液中滴加盐酸酸化的 | 原溶液中一定含有 |
B | 将 |
|
C | 用蒸馏水润湿的pH试纸测溶液的pH | 一定会使测定结果偏低 |
D | 向混有乙酸和乙醇的乙酸乙酯中加入氢氧化钠溶液 | 除去溶液中的乙酸和乙醇 |
A.AB.BC.CD.D
【题目】已知水在25 ℃和95 ℃时,其电离平衡曲线如下图所示:
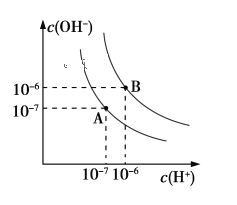
(1)则25 ℃时水的电离平衡曲线应为_______(填“A”或“B”),请说明理由_____________________。
(2)25 ℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若混合溶液的pH=7,则NaOH溶液与pH=4的H2SO4溶液的体积比为________。
(3)95 ℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,a+b=_______________
(4)曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5,则HA为_______(填“强”或“弱”)酸
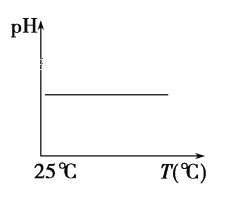
(5)下列溶液pH随温度的变化如图所示的是______(不考虑溶质、溶剂挥发)
a.稀硫酸 b.NaOH溶液 c.NaCl 溶液 d.氨水 e.醋酸
(6)下表室温下为几种弱电解质的电离平衡常数
CH3COOH | H2CO3 | H2S | NH3·H2O |
1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | 1.8×10-5 |
少量CO2与NaHS反应的离子方程式为_________________________________________。室温下,CH3COONH4溶液的pH_________7(填“>”、“<”或“=”)
(7)25 ℃时,如果取0.1 mol·L-1HA溶液与0.1 mol·L-1 NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,原因是___________________________________________(用离子方程式表示)