题目内容
【题目】下列实验中根据现象得出的结论错误的是
选项 | 实验 | 现象 | 结论 |
A | 向 | 先出现白色沉淀,最终沉淀又溶解 | Y可能是 |
B | 向某溶液中加入Cu和浓 | 试管口有红棕色气体产生 | 原溶液可能含有 |
C | 将Na投到一定浓度的 | 出现气泡并有固体生成 | Na与 |
D | 向浓度均为 | 先出现蓝色沉淀 |
|
A.AB.
【答案】C
【解析】
![]() 向
向![]() 溶液中持续通入气体Y,先出现白色沉淀,最终沉淀又溶解,说明Y溶于水呈酸性,可能为HCl或
溶液中持续通入气体Y,先出现白色沉淀,最终沉淀又溶解,说明Y溶于水呈酸性,可能为HCl或![]() ,故A不选;
,故A不选;
B.向某溶液中加入Cu和浓![]() ,试管口有红棕色气体产生,该气体为二氧化氮,则说明溶液中含有
,试管口有红棕色气体产生,该气体为二氧化氮,则说明溶液中含有![]() ,故B不选;
,故B不选;
C.钠先和水反应为氧化还原反应,氧化剂![]() ,被氧化的元素Na,氧化产物NaOH,生成NaOH和氢气,反应的化学方程式为:
,被氧化的元素Na,氧化产物NaOH,生成NaOH和氢气,反应的化学方程式为:![]() ,离子反应为
,离子反应为![]() ,NaOH与硫酸铜发生复分解反应,反应的化学方程式为
,NaOH与硫酸铜发生复分解反应,反应的化学方程式为![]() ,生成氢氧化铜和硫酸钠,离子反应为:
,生成氢氧化铜和硫酸钠,离子反应为:![]() ,总反应为:
,总反应为:![]() ,故C选;
,故C选;
D.向浓度均为![]() 的
的![]() 、
、![]() 混合溶液中逐滴加入氨水,先出现蓝色沉淀,说明氢氧化铜的溶度积较小,即
混合溶液中逐滴加入氨水,先出现蓝色沉淀,说明氢氧化铜的溶度积较小,即![]() ,故D不选;
,故D不选;
故选:C。

【题目】已知水在25 ℃和95 ℃时,其电离平衡曲线如下图所示:
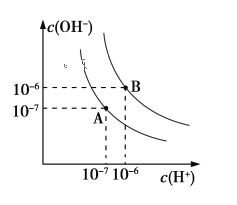
(1)则25 ℃时水的电离平衡曲线应为_______(填“A”或“B”),请说明理由_____________________。
(2)25 ℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若混合溶液的pH=7,则NaOH溶液与pH=4的H2SO4溶液的体积比为________。
(3)95 ℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,a+b=_______________
(4)曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5,则HA为_______(填“强”或“弱”)酸
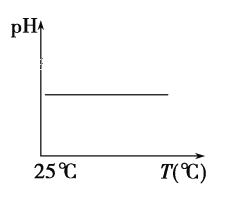
(5)下列溶液pH随温度的变化如图所示的是______(不考虑溶质、溶剂挥发)
a.稀硫酸 b.NaOH溶液 c.NaCl 溶液 d.氨水 e.醋酸
(6)下表室温下为几种弱电解质的电离平衡常数
CH3COOH | H2CO3 | H2S | NH3·H2O |
1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | 1.8×10-5 |
少量CO2与NaHS反应的离子方程式为_________________________________________。室温下,CH3COONH4溶液的pH_________7(填“>”、“<”或“=”)
(7)25 ℃时,如果取0.1 mol·L-1HA溶液与0.1 mol·L-1 NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,原因是___________________________________________(用离子方程式表示)