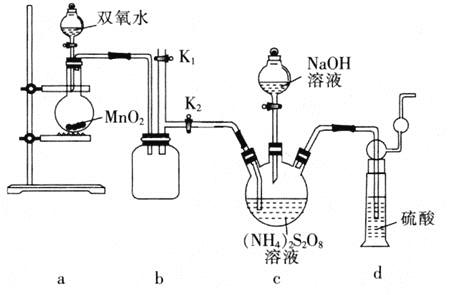
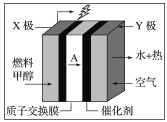
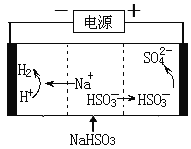
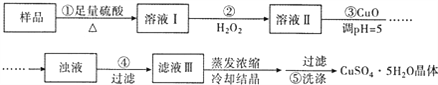
题目内容
【题目】已知:pOH=﹣lgc(OH﹣),298K时,向20.00 mL 0.10 molL﹣1氨水中滴入0.10 molL﹣1的盐酸,溶液的pH和pOH与加入盐酸体积关系如图所示.下列说法正确的是( )

A.曲线PJN表示溶液中pH的变化
B.M点水的电离程度比J点大
C.M、P两点的数值之和a+b=14
D.pH与pOH交叉点J对应的V(盐酸)=20.00 mL
【答案】C
【解析】
pH越大,说明溶液碱性越强,pOH越大,说明溶液酸性越强;
A.根据图知,随着盐酸的加入,氨水溶液中pH减小、pOH增大,所以PJN为溶液中的pOH变化曲线,曲线MJQ表示溶液中pH变化曲线,故A错误;
B.M点pH比J点的pH大,说明J点溶液中NH4+的水解程度大,即M点水的电离程度比J点小,故B错误;
C.根据图知,PJN曲线表示pOH变化、MJQ曲线表示pH变化,M、P点为酸碱中和同一点,M点pH=a、P点pOH=b,则M点c(H+)=10-a mol/L、P点c(OH-)=10-bmol/L,相同温度下c(H+)c(OH-)=Kw,所以M、P两点的数值之和a+b=14,故C正确;
D.pH与pOH交叉点JpH=pOH,则c(H+)=c(OH-),为中性溶液,一水合氨是弱碱,要使混合溶液呈中性,则氨水应该稍微过量,所以盐酸体积小于20mL,故D错误;
故答案为C。

【题目】已知水在25 ℃和95 ℃时,其电离平衡曲线如下图所示:
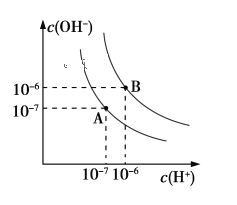
(1)则25 ℃时水的电离平衡曲线应为_______(填“A”或“B”),请说明理由_____________________。
(2)25 ℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若混合溶液的pH=7,则NaOH溶液与pH=4的H2SO4溶液的体积比为________。
(3)95 ℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,a+b=_______________
(4)曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5,则HA为_______(填“强”或“弱”)酸
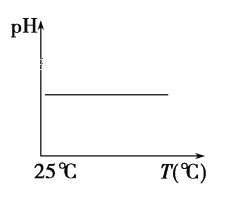
(5)下列溶液pH随温度的变化如图所示的是______(不考虑溶质、溶剂挥发)
a.稀硫酸 b.NaOH溶液 c.NaCl 溶液 d.氨水 e.醋酸
(6)下表室温下为几种弱电解质的电离平衡常数
CH3COOH | H2CO3 | H2S | NH3·H2O |
1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | 1.8×10-5 |
少量CO2与NaHS反应的离子方程式为_________________________________________。室温下,CH3COONH4溶液的pH_________7(填“>”、“<”或“=”)
(7)25 ℃时,如果取0.1 mol·L-1HA溶液与0.1 mol·L-1 NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,原因是___________________________________________(用离子方程式表示)