题目内容
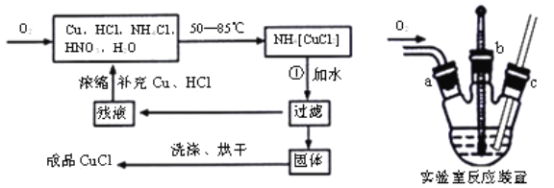
【题目】Ⅰ.现代工业常以氯化钠为原料制备纯碱,部分工艺流程如下:
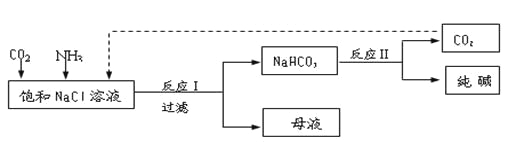
已知NaHCO3在低温下溶解度较小。
反应Ⅰ:NaCl+CO2+NH3+H2O![]() NaHCO3↓+NH4Cl,处理母液的两种方法:
NaHCO3↓+NH4Cl,处理母液的两种方法:
(1)向母液中加入石灰乳,可将其中________循环利用。
(2)向母液中通入NH3,加入细小的食盐颗粒并降温,可得到NH4Cl晶体。试写出通入NH3后,溶解度较小的酸式碳酸盐转变为溶解度较大的碳酸盐的离子方程式 ___________。
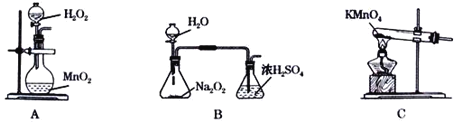
Ⅱ.某化学小组模拟“侯氏制碱法”,以NaCl、NH3、CO2和水等为原料以及下图所示装置制取NaHCO3,然后再将NaHCO3制成Na2CO3。

(1)装置丙中冷水的作用是_________;
(2)由装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有_______、洗涤、灼烧。NaHCO3转化为Na2CO3的化学方程式为______;
(3)若在(2)中灼烧的时间较短,NaHCO3将分解不完全,该小组对一份加热了t1 min的NaHCO3 样品的组成进行了以下探究。
取加热了t1 min的NaHCO3样品29.6 g完全溶于水制成溶液,然后向此溶液中缓慢地滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中有关离子的物质的量的变化如图所示。
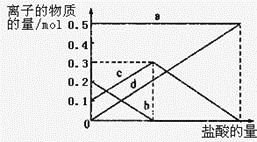
则曲线a对应的溶液中的离子是___________(填离子符号下同);曲线c对应的溶液中的离子是___________;该样品中NaHCO3和Na2CO3的物质的量之比是___________; 21
(4)若取21.0 g NaHCO3固体,加热了t2rnin后,剩余固体的质量为l4.8 g。如果把此剩余固体全部加入到200 mL 2 molL—1的盐酸中,则充分反应后溶液中H+ 的物质的量浓度为____________(设溶液体积变化忽略不计)
【答案】NH3 HCO3–+NH3=NH4++CO32– 冷却,使碳酸氢钠晶体析出 过滤 2NaHCO3![]() Na2CO3+H2O+CO2↑ Na+ HCO3- 1:2 0.75 mol/L
Na2CO3+H2O+CO2↑ Na+ HCO3- 1:2 0.75 mol/L
【解析】
Ⅰ(1)根据流程可知,母液中含有氯化铵,加入石灰乳后可以生成氨气;
(2)根据氨水电离成铵根和氢氧根离子,增大铵根的浓度有利于氯化铵的析出来分析,溶液碱性增强,使碳酸氢钠转换为溶解度较大的碳酸钠;
Ⅱ.(1)温度越低,NaHCO3的溶解度越小;
(2)装置丙中是氨化的饱和食盐水中通入二氧化碳生成碳酸氢钠晶体,通过过滤得到晶体洗涤灼烧得到碳酸钠;NaHCO3转化为Na2CO3的方法是固体加热分解;
(3)混合物是碳酸钠和碳酸氢钠,滴入盐酸发生反应CO32-+H+=HCO3-; HCO3-+H+=CO2↑+H2O;依据图象分析碳酸根离子减小,碳酸氢根离子增多;
(4)依据反应前后质量变化是碳酸氢钠分解的原因,依据反应前后质量变化计算反应的碳酸氢钠和生成的碳酸钠,结合试样质量计算剩余碳酸氢钠,计算得到混合物反应消耗的氢离子得到。
Ⅰ.(1)向分离出NaHCO3晶体后的母液NH4Cl中加入过量石灰乳,发生的反应有Ca(OH)2+2NH4Cl=2NH3↑+2H2O+CaCl2,最终产物为氯化钙、氨气,其中氨气可再利用,
故答案为:NH3;
(2)通入NH3后,溶解度较小的酸式碳酸盐转变为溶解度较大的碳酸盐的离子方程式HCO3–+NH3=NH4++CO32–。
Ⅱ.(1)装置丙中冷水的作用是降温,使碳酸氢钠晶体析出。
(2)由装置丙中产生的NaHCO3发生的反应为,NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl;制取Na2CO3时需要过滤得到晶体,洗涤后加热灼烧得到碳酸钠;2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
(3)溶液中有关离子的物质的量的变化为:钠离子始终不变,碳酸根离子减小,碳酸氢根离子浓度增大,当碳酸根离子全部转化为碳酸氢根离子,再滴入盐酸和碳酸氢根离子反应生成二氧化碳,碳酸氢根离子减小,所以c曲线表示的是碳酸氢根离子浓度变化;碳酸根离子浓度0.2mol/L;碳酸氢根离子浓度为0.1mol/L;样品中NaHCO3和Na2CO3的物质的量之比是1:2; 故答案为:Na+ ;HCO3-; 1:2;
(4)若取21g NaHCO3固体物质的量=![]() =0.25mol,加热了t1min后,剩余固体的质量为14.8g.依据化学方程式存在的质量变化计算:
=0.25mol,加热了t1min后,剩余固体的质量为14.8g.依据化学方程式存在的质量变化计算:
2NaHCO3=Na2CO3+CO2↑+H2O △m
2 1 62
0.2mol 0.1mol 21g-14.8g
反应后NaHCO3物质的量=0.25mol-0.2mol=0.05mol;NaHCO3+HCl=NaCl+H2O+CO2↑;消耗氯化氢物质的量0.05mol;
Na2CO3物质的量=0.1mol,Na2CO3+2HCl=2NaCl+H2O+CO2↑,消耗氯化氢物质的量0.2mol;
剩余氯化氢物质的量=0.200L×2mol/L-0.05mol-0.2mol=0.15mol,剩余溶液中c(H+)=
![]() =0.75mol/L故答案为:0.75mol/L。
=0.75mol/L故答案为:0.75mol/L。

【题目】异丁烷脱氢制异丁烯反应为:![]()
副反应为裂解反应:![]()
![]() 已知:
已知:
化学键 | | | | |
键能 | 412 | 348 | 612 | 436 |
试计算异丁烷脱氢反应的![]() ______
______![]()
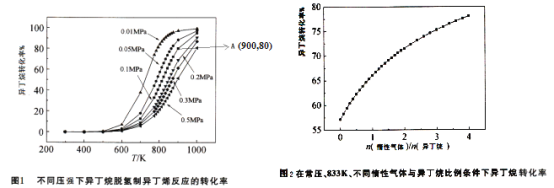
![]() 不同压强条件下异丁烷脱氢反应的转化率如图1所示。下列说法不正确的是______。
不同压强条件下异丁烷脱氢反应的转化率如图1所示。下列说法不正确的是______。
A.主反应和副反应均在低温条件下自发
B.开发高选择性的催化剂,有效抑制副反应的发生,可提高异丁烯的选择性
C.由图1可知,![]() 范围内,温度不变,压强增大,异丁烷脱氢反应的转化率降低
范围内,温度不变,压强增大,异丁烷脱氢反应的转化率降低
D.选择合适的温度,使催化剂的活性最大,有利于提高异丁烷的平衡转化率
![]() 平衡常数的表达式中平衡浓度可以用平衡时各气体的分压代替
平衡常数的表达式中平衡浓度可以用平衡时各气体的分压代替![]() 分压
分压![]() 物质的量分数
物质的量分数![]() 总压强
总压强![]() 。图1中,A点状态下的异丁烷脱氢反应的平衡常数
。图1中,A点状态下的异丁烷脱氢反应的平衡常数![]() ______
______![]() 保留两位有效数字
保留两位有效数字![]() 。
。
![]() 常压、833K条件下,异丁烷脱氢制异丁烯的转化率随着惰性气体与异丁烷比例的变化情况如图2,请解释随着惰性气体与异丁烷比例的增加,异丁烷转化率逐渐增加的原因:______。
常压、833K条件下,异丁烷脱氢制异丁烯的转化率随着惰性气体与异丁烷比例的变化情况如图2,请解释随着惰性气体与异丁烷比例的增加,异丁烷转化率逐渐增加的原因:______。
![]() 请在图2中画出温度为
请在图2中画出温度为![]() ,其他条件不变时,异丁烷转化率图象。
,其他条件不变时,异丁烷转化率图象。
![]() 科学家发现,以
科学家发现,以![]() 和
和![]() 为原料,熔融
为原料,熔融![]() 为电解质,纳米
为电解质,纳米![]() 作催化剂,在
作催化剂,在![]() 和常压下可实现电化学合成氨。阴极区发生的变化可视为按两步进行,请补充完整。电极反应式:______和
和常压下可实现电化学合成氨。阴极区发生的变化可视为按两步进行,请补充完整。电极反应式:______和![]() 。
。