题目内容
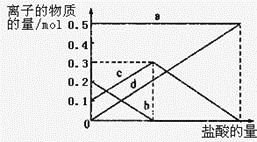
【题目】常温下,已知Ka1(H2CO3)=4.3×10-7, Ka2(H2CO3)=5.6×10-11。 某二元酸H2R及其钠盐的溶液中,H2R、HR-、R2-三者的物质的量分数随溶液pH变化关系如图所示,下列叙述错误的是( )
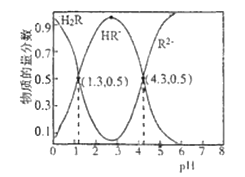
A.H2R的一级电离常数Ka1的数量级为10-2
B.在pH=4.3的溶液中:3c(R2-)=c(Na+ )+c(H+)-c(OH-)
C.等体积、等浓度的NaOH溶液与H2R溶液混合后,溶液中: c(R2- )>c(H2R)
D.向Na2CO3溶液中加入少量H2R溶液,发生的反应是: CO32- +H2R=HCO3-+HR-
【答案】D
【解析】
二元酸H2X存在两步电离:H2R![]() HR -+H+,Ka1=
HR -+H+,Ka1=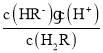 =1.0×10-1.3[根据图上第一个交点,c(H2R)=c(HR-),那么Ka1= c(H+ )= 1.0×10-1.3];HR-
=1.0×10-1.3[根据图上第一个交点,c(H2R)=c(HR-),那么Ka1= c(H+ )= 1.0×10-1.3];HR- ![]() R 2- + H+,Ka2=
R 2- + H+,Ka2=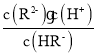 =1.0×10-4.3[根据图上的第二个交点,c(R2-)=c(HR-),那么Ka2=c(H+ )= 1.0×10-4.3];R2-发生两步水解:R2- + H2O
=1.0×10-4.3[根据图上的第二个交点,c(R2-)=c(HR-),那么Ka2=c(H+ )= 1.0×10-4.3];R2-发生两步水解:R2- + H2O![]() HR -+OH-,
HR -+OH-,![]() ;HR -+ H2O
;HR -+ H2O![]() H2R+ OH-,
H2R+ OH-,![]() =
=![]() 。
。
A. 根据分析,H2R的一级电离常数Ka1=1.0×10-1.3,则数量级为10-2,A项正确;
B. 如图在pH=4.3时溶液中c(R2-) = c(HR-),溶液中电荷守恒为c(Na+ )+c(H+)=2c(R2-) + c(HR-)+c(OH-),故3c(R2-)=c(Na+ )+c(H+)-c(OH-),B项正确;
C. 等体积、等浓度的NaOH溶液与H2R溶液混合后,二者恰好反应生成NaHR,HR-可以电离也可以水解,由于Ka2=1.0×10-4.3大于Kh2=![]() ,所以以电离为主,溶液显酸性,则电离产物c(R2- )大于水解产物c(H2R),C项说法正确;
,所以以电离为主,溶液显酸性,则电离产物c(R2- )大于水解产物c(H2R),C项说法正确;
D. 根据弱酸的电离平衡常数越大酸性越强,由于Ka1(H2R)>Ka2(H2R)>Ka1(H2CO3)>Ka2(H2CO3),可得酸性:H2R>HR>H2CO3>HCO3,可得酸根离子结合氢离子能力:CO32->HCO3>R2->HR;那么向Na2CO3溶液中加入少量H2R溶液,因为是少量酸性溶液,只能将CO32-转化为HCO3,酸性不足还不能生成HR,仍然以R2-形式存在,故发生的反应是:2CO32- +H2R= 2HCO3+ R2-,D项错误;
答案选D。

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案【题目】已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O.
某化学小组根据上述反应原理进行下列实验:
I.测定H2C2O4溶液的物质的量浓度
实验步骤如下:
①取待测H2C2O4溶液25.00mL放入锥形瓶中,再加入适量的稀硫酸;
②用0.1mol/LKMnO4溶液滴定至终点,记录数据;
③重复滴定2次,平均消耗KMnO4溶液20.00mL。
请回答:
(1)滴定时,将KMnO4溶液装在______(填“酸式”或“碱式”)滴定管中。
(2)若在步骤①操作之前,先用待测H2C2O4溶液润洗锥形瓶,则测得H2C2O4溶液的浓度会______(填“偏大”“偏小”或“无影响”)。
(3)步骤②中到达滴定终点时的现象为_______________________________。
(4)计算H2C2O4溶液的物质的量浓度为__________mol/L。
II.探究反应物浓度对化学反应速率的影响设计如下实验方案(实验温度均为25℃):
实验序号 | 体积V/mL | |||
0.1molL-1KMnO4溶液 | 0.11molL-1H2C2O4溶液 | 0.11molL-1H2SO4溶液 | H2O | |
① | 2.0 | 5.0 | 6.0 | 7.0 |
② | 2.0 | 8.0 | 6.0 | V1 |
③ | 2.0 | V2 | 6.0 | 2.0 |
请回答:
(5)表中v1=______。
(6)实验中需要测量的数据是______________________________。
(7)实验中______(填“能”或“不能”)用0.2mol/L盐酸代替0.1mol/LH2SO4溶液,理由是_________。