题目内容
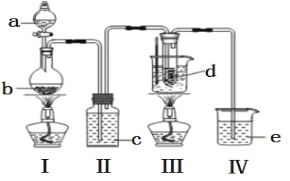
【题目】氯化亚铜(CuCl)广泛应用于有机合成、染料、颜料、催化剂等工业。它是一种白色粉末,微溶于水,不溶于乙醇、稀硝酸及稀硫酸,可溶于氨水、浓盐酸,并生成配合物NH4[CuCl2];能在空气中迅速被氧化成绿色;见光则分解,变成褐色。下图是实验室制备氯化亚铜的流程图及实验装置图。
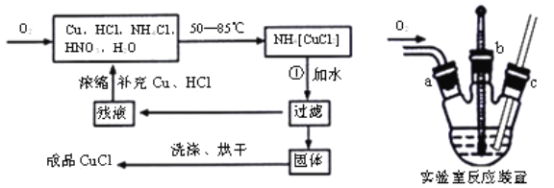
实验药品:铜丝20g、氯化铵20g、65%硝酸l0mL、36%盐酸15mL、水。
(1)请写出①的化学方程式____________________________________。
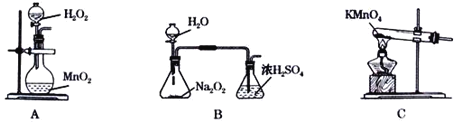
(2)本实验中通入O2的速率不宜过大,宜选择下图中的____(填字母序号)方案,并说明选择该装置的理由__________________________________________。
(3)电炉加热升温至50℃时停止加热,反应快速进行,当烧瓶中液面上方的现象为_____时,停止通入氧气,打开瓶塞,沿C口倾出反应液于l000mL大烧杯中,加水500mL,即刻有大量白色沉淀析出。
(4)关于该实验过程中,下列说法正确的是_________________。
A 实验开始时,温度计显示反应液温度可能低于室温。
B 流程中过滤操作,可以采用真空抽滤的方式,洗涤固体可以用95%的酒精。
C 该实验流程中,残液中补充HCl的主要作用是抑制产物的水解。
D 反应装置中使用长导管的目的是防止三颈烧瓶内气压过大。
(5)氯化亚铜的定量
①称取成品0.25g置于预先放入玻璃珠30粒和l0mL过量的FeCl3溶液的250mL锥形瓶中,不断摇动;
②待样品溶解后,加水50mL,邻菲罗啉指示剂2滴;
③立即用0.l0 mol·L-1硫酸铈标准溶液滴至绿色出现为终点并记录读数,再重复实验二次,测得数据如下表。(已知:CuCl + FeCl3 = CuCl2 + FeCl2 ,Fe2+ + Ce4+ = Fe3+ + Ce3+)
实验序号 | 1 | 2 | 3 |
滴定起始读数(mL) | 0.75 | 0.50 | 0.80 |
滴定终点读数(mL) | 24.70 | 24.95 | 24.85 |
④数据处理:计算得CuCl的纯度为__________。
【答案】NH4[CuCl2]=CuCl↓+NH4Cl B 通过观察锥形瓶中产生气泡的快慢可以控制O2的速率 红棕色气体逐渐变为无色 ABD 95.5%或95.52%
【解析】
根据流程:氧气通入Cu、HCl、NH4Cl、HNO3、H2O的混合物中控制温度50~85℃制得NH4[CuCl2],加入水,过滤得到CuCl沉淀和含有NH4Cl的母液,母液浓缩补充Cu、HCl可循环,沉淀洗涤干燥后得产品。
(1)根据工艺流程可知,反应①过滤后,滤饼用酒精洗涤的CuCl,说明反应生成CuCl,还生成氯化铵,反应方程式为:NH4[CuCl2]=CuCl↓+NH4Cl;
故答案为:NH4[CuCl2]=CuCl↓+NH4Cl;
(2)B装置可以根据锥形瓶内气泡的快慢判断产生O2的速率进行控制,A.C装置无法判断通入氧气的速率,故选择B装置,
故答案为:B;通过观察锥形瓶中产生气泡的快慢可以控制O2的速率;
(3)电炉加热升温至50℃时停止加热,反应快速进行,有红棕色二氧化氮气体生成,当烧瓶中液面上方红棕色气体逐渐变为无色时,停止通入氧气;
故答案为:红棕色气体逐渐变为无色;
(4)A.氯化铵溶于水吸收热量,造成反应液温度降低,故A正确;
B. 流程中过滤操作,可以采用真空抽滤的方式,CuCl微溶于水,用酒精洗去晶体表面的杂质离子及水分,避免CuCl溶于水而造成损耗,故B正确;
C. 该实验流程中,残液中补充的HCl是反应物,故C错误;
D. 反应装置中使用长导管可以防止三颈烧瓶内气压过大,故D正确;
故答案为:ABD;
(5)第二组实验数据误差较大,舍去,故硫酸铈标准溶液平均消耗24mL,根据关系式有:CuClFeCl3Ce4+,则n(CuCl)=n(Ce4+),故m(CuCl)=0.10mol/L×0.024L×99.5g/mol=0.2388g,CuCl的纯度为0.2388g÷0.25g×100%=95.5%或95.52%;
故答案为:95.5%或95.52%。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】Ⅰ.利用测压法在刚性反应器中研究 T℃ 时:
3NO2(g)![]() 3NO(g)+O3(g) ΔH=+317.3kJ·mol-1的分解反应,体系的总压强 p随时间 t 的变化如下表所示:
3NO(g)+O3(g) ΔH=+317.3kJ·mol-1的分解反应,体系的总压强 p随时间 t 的变化如下表所示:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
压强/MPa | 20.00 | 21.38 | 22.30 | 23.00 | 23.58 | 24.00 | 24.00 |
(1)该反应达到平衡后的熵值较平衡前______________(填“增大”“减小”“不变”)。
(2)若降低反应温度,则平衡后体系压强 p____24.00 MPa(填“大于”“等于”“小于”),原因是_____________________________________________________________________。15min 时,反应物的转化率 α=__________%
Ⅱ.一定条件下,在体积为 2 L 的密闭容器中发生反应:2NO2(g)![]() 2NO(g)+O2(g) ΔH>0。投入 2 mol NO2发生反应。实验测得:v正=k正c2(NO2),v逆=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。在温度为 T℃ 时 NO2 的转化率随时间变化的结果如图所示。
2NO(g)+O2(g) ΔH>0。投入 2 mol NO2发生反应。实验测得:v正=k正c2(NO2),v逆=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。在温度为 T℃ 时 NO2 的转化率随时间变化的结果如图所示。
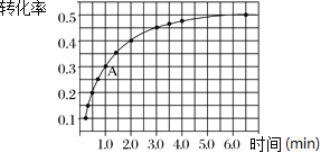
(1)要提高 NO2转化率,可采取的措施是________________ 、__________________。
(2)前2min内,以NO2表示该反应的化学反应速率为___________________。
(3)计算 A 点处v正/ v逆=_________________(保留一位小数)。