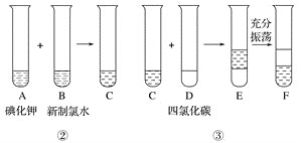
题目内容
【题目】如图所示,两圆圈相交的阴影部分表示圆圈内物质相互发生的反应。钠及其氧化物的物质的量 均为0.1 mol,水的质量为100 g。下列说法正确的是

A.甲、乙、丙都属于氧化还原反应
B.甲反应的离子方程式为Na+2H2O![]() Na++2OH-+H2↑
Na++2OH-+H2↑
C.丙充分反应,能产生0.05 mol O2,转移电子0.1 mol
D.甲、乙、丙充分反应后所得溶液的质量分数分别为w1、w2、w3,则2w1=w2=w3
【答案】C
【解析】
A.氧化钠和水反应生成氢氧化钠,该反应中没有电子转移,不属于氧化还原反应,故A错误;
B.甲的离子方程式为2Na+2H2O═2Na++2OH-+H2↑,故B错误;
C.过氧化钠和水反应时,过氧化钠中O元素化合价由-1价变为0价和-2价,过氧化钠既是氧化剂又是还原剂,且有一半的过氧化钠作氧化剂、有一半的过氧化钠作还原剂,所以丙充分反应,能产生0.05molO2,转移电子物质的量=0.05mol×2=0.1mol,故C正确;
D.钠、氧化钠、过氧化钠和水反应的方程式分别如下:
Na+H2O=NaOH+![]() H2↑,溶液增加的质量=m(Na)-m(H2)=2.3g-0.1g=2.2g;
H2↑,溶液增加的质量=m(Na)-m(H2)=2.3g-0.1g=2.2g;
Na2O+H2O=2NaOH,溶液增加的质量=m(Na2O)=0.1mol×62g/mol=6.2g;
Na2O2+H2O=2NaOH+![]() O2↑,溶液增加的质量=m(Na2O2)-m(O2)=m(Na2O)=6.2g;
O2↑,溶液增加的质量=m(Na2O2)-m(O2)=m(Na2O)=6.2g;
所以溶液增加的质量大小顺序为:钠<氧化钠=过氧化钠,
根据钠原子守恒知,0.1mol的钠、氧化钠、过氧化钠、溶于水所得氢氧化钠的物质的量分别为:0.1mol、0.2mol、0.2mol,通过以上分析可知,0.1mol的钠、氧化钠、过氧化钠分别溶于水所得溶液的质量分数分别为:w1=![]() 、w2=
、w2=![]() 、w3=
、w3=![]() ,则:2w1>w2=w3,故D错误;
,则:2w1>w2=w3,故D错误;
答案选C。

 阅读快车系列答案
阅读快车系列答案